Автор: Омаров Арип Шамильевич — подолог, ортопед, подиатр, хирург, детский подолог, специалист по анализам крови.
Выбор лекарства от грибка ногтей зависит от типа возбудителя и степени поражения ногтевой пластины. При начальных стадиях онихомикоза достаточно местных препаратов на основе аморолфина или нафтифина, тогда как при поражении более 2/3 пластины требуется системная терапия таблетками тербинафина или итраконазола. Дерматофиты составляют 90% случаев грибковых инфекций ногтей, однако дрожжевые и плесневые грибки требуют иного подхода к лечению. Разбираем механизмы действия основных противогрибковых препаратов, сравниваем эффективность системных и местных форм, анализируем компромиссы между скоростью терапии и риском побочных эффектов.
Что такое грибок ногтей на ногах и какие возбудители его вызывают
Онихомикоз представляет собой инфекционное поражение ногтевой пластины патогенными грибами, которое диагностируется у 10-26% населения в зависимости от региона и возрастной группы. Заболевание вызывают три основные группы возбудителей: дерматофиты (60-90% случаев), дрожжевые грибки рода Candida (5-17%) и плесневые грибы (3-15%), причём их распространённость напрямую зависит от возраста пациента, состояния иммунной системы и сопутствующих патологий.
Главным возбудителем онихомикоза стоп является Trichophyton rubrum, на долю которого приходится 70-95% всех подтверждённых случаев дерматофитной инфекции ногтей. Этот антропофильный гриб получает питание, растворяя кератины ногтевой пластины, что приводит к её постепенному разрушению. Второй по распространённости дерматофит Trichophyton mentagrophytes (7-24% случаев) чаще поражает межпальцевые промежутки с последующим переходом на ногти, осложняя течение болезни образованием болезненных трещин.
Диагностика типа возбудителя требует лабораторного подтверждения методами микроскопии и культурального исследования, поскольку клинические проявления разных видов грибков часто совпадают. Специалисты в области подологии проводят дифференциальную диагностику с использованием современного оборудования — посетите кабинет подолога для точного определения возбудителя и подбора эффективной терапии. Точная идентификация патогена критична для выбора противогрибкового препарата, так как дерматофиты, дрожжевые и плесневые грибы демонстрируют различную чувствительность к антимикотикам.
Согласно данным российских исследований 2016 года, опубликованным в журнале «Вестник дерматологии», дерматомицеты рода Trichophyton составляют 79,55% от всех выделенных возбудителей онихомикоза, что подтверждает их доминирующую роль в этиологии заболевания.
Факторы риска развития онихомикоза включают возраст старше 60 лет (встречаемость повышается в 2,5 раза), сахарный диабет (риск возрастает в 3 раза), нарушение периферического кровообращения, иммунодефицитные состояния и микротравмы ногтевой пластины. Профессиональные группы риска охватывают строителей, спортсменов, военнослужащих и работников бассейнов, где тёплая влажная среда создаёт оптимальные условия для передачи инфекции. Инкубационный период после контакта с возбудителем варьирует от нескольких недель до месяцев, в течение которых споры грибов закрепляются в микроповреждениях ногтевого аппарата.
Почему дерматофиты составляют 90% всех случаев онихомикоза
Дерматофиты доминируют в структуре возбудителей онихомикоза благодаря уникальной способности синтезировать кератинолитические ферменты, которые расщепляют кератин — основной структурный белок ногтевой пластины, составляющий до 95% её массы. В отличие от дрожжевых и плесневых грибов, дерматофиты эволюционно специализировались на колонизации кератинизированных тканей (ногти, волосы, роговой слой эпидермиса), что обеспечивает им конкурентное преимущество при инфицировании ногтевого аппарата.
Trichophyton rubrum демонстрирует феноменальную адаптацию к паразитированию на человеке: этот антропофильный гриб передаётся исключительно от человека к человеку и способен существовать в роговых структурах десятилетиями без лечения. Механизм инвазии включает прикрепление артроконидий (спор) к поверхности ногтя, прорастание гиф через микротрещины и последующее распространение по всей толщине пластины со скоростью роста ногтя (1-1,5 мм в месяц для ног). Компромисс эволюционной специализации заключается в том, что дерматофиты не могут поражать внутренние органы даже при выраженном иммунодефиците, в отличие от дрожжевых грибов Candida.
| Характеристика | Дерматофиты | Дрожжевые грибки | Плесневые грибки |
|---|---|---|---|
| Доля в этиологии онихомикоза | 60-90% | 5-17% | 3-15% |
| Основной возбудитель | Trichophyton rubrum | Candida albicans | Scopulariopsis brevicaulis |
| Предпочтительная локализация | Ногти стоп (85%) | Ногти кистей (70%) | Повреждённые ногти |
| Скорость прогрессирования | Медленная (месяцы-годы) | Средняя (недели-месяцы) | Вариабельная |
| Ответ на стандартную терапию | 95% при тербинафине | 70-80% при флуконазоле | Низкий (30-50%) |
Высокая контагиозность дерматофитов объясняется устойчивостью их спор в окружающей среде: артроконидии сохраняют жизнеспособность на поверхностях в общественных душевых, саунах и спортзалах до 12-18 месяцев. Эпидемиологические исследования показывают, что у 30-50% членов семьи пациента с онихомикозом обнаруживается носительство или активная инфекция тем же штаммом Trichophyton rubrum. Цена этой распространённости — необходимость одновременного лечения всех инфицированных домочадцев и тщательной дезинфекции обуви, носков и поверхностей для предотвращения реинфекции.
Почему Trichophyton rubrum так успешен в качестве патогена
Молекулярные исследования выявили у T. rubrum способность подавлять локальный иммунный ответ через секрецию протеаз, разрушающих иммуноглобулины и компоненты комплемента. Гриб формирует биоплёнки на поверхности ногтя, которые снижают проникновение противогрибковых препаратов на 40-60% по сравнению с планктонными формами. Дополнительно T. rubrum синтезирует меланин-подобные пигменты, защищающие его от ультрафиолета и окислительного стресса, что объясняет неэффективность некоторых физиотерапевтических методов лечения.
Чем отличаются дрожжевые и плесневые грибки от дерматофитов
Дрожжевые грибки рода Candida и плесневые грибы принципиально отличаются от дерматофитов экологической нишей, механизмом патогенеза и клиническими проявлениями. Candida albicans является условно-патогенным микроорганизмом, постоянно присутствующим на слизистых оболочках и коже у 40-60% здоровых людей, тогда как дерматофиты представляют собой облигатные патогены, всегда вызывающие заболевание при инфицировании.
Кандидозный онихомикоз развивается преимущественно на ногтях кистей (70% случаев) у лиц с частым контактом с водой и моющими средствами: кондитеров, уборщиц, посудомойщиц, медицинских работников. Патогенез начинается с поражения околоногтевого валика (паронихии), который становится отёчным, болезненным и гиперемированным, с последующим распространением на ногтевую пластину от проксимального края. Характерная особенность — зеленовато-коричневая окраска ногтя и поперечные борозды Бо, отражающие эпизоды обострения воспаления. Компромисс локализации: кандидозное поражение ногтей стоп встречается крайне редко (менее 5% случаев), что связано с отсутствием постоянной влажности.
Плесневые грибы (роды Scopulariopsis, Aspergillus, Fusarium, Acremonium) выступают возбудителями онихомикоза преимущественно у пожилых пациентов старше 65 лет с уже повреждёнными ногтевыми пластинами травмами, псориазом или предшествующей дерматофитной инфекцией. Эти убиквитарные почвенные сапрофиты не обладают специфическими механизмами адаптации к паразитированию на человеке, поэтому колонизируют только ногти с нарушенной барьерной функцией. Диагностическим маркером служит необычная окраска ногтя: чёрная при Aspergillus niger, зелёная при Aspergillus flavus, белая при Scopulariopsis brevicaulis.
| Критерий сравнения | Дерматофиты | Дрожжевые грибки | Плесневые грибки |
|---|---|---|---|
| Патогенность | Облигатные патогены | Условно-патогенные | Сапрофиты-оппортунисты |
| Источник инфекции | Больной человек | Собственная микрофлора | Почва, растения |
| Начало поражения ногтя | Дистальный край (90%) | Проксимальный край + валик | Дистальный край |
| Паронихия (воспаление валика) | Редко (5-10%) | Всегда первична | Отсутствует |
| Требование к иммунитету | Любой статус | Снижение местного/общего | Выраженный иммунодефицит |
Принципиальное отличие в терапевтическом подходе заключается в чувствительности к антимикотикам: дерматофиты демонстрируют 95%-ную эффективность элиминации при применении тербинафина в течение 12-16 недель, тогда как кандидозный онихомикоз требует назначения азолов (флуконазол, итраконазол) с эффективностью 70-80%. Плесневые грибы характеризуются природной резистентностью к большинству системных антимикотиков, что делает их лечение наиболее сложной задачей: успех терапии достигается лишь в 30-50% случаев даже при длительных курсах высоких доз препаратов. Цена ошибки в идентификации возбудителя — неэффективное лечение, прогрессирование инфекции и развитие необратимой дистрофии ногтевой пластины с необходимостью её хирургического удаления.
Исследование этиологических особенностей онихомикоза, проведённое в 2016 году, показало, что смешанная этиология (одновременное присутствие дерматофитов и недерматофитных грибов) встречается в 5% случаев и ассоциирована с 2-кратным увеличением длительности лечения до достижения микологического излечения.
Клиническая дифференциация типов возбудителей опирается на совокупность признаков: при дерматофитии характерны подногтевой гиперкератоз, желтовато-белая окраска и онихолизис (отслоение от ложа), при кандидозе — первичная паронихия с вторичным поражением ногтя и поперечные борозды, при плесневой инфекции — необычная пигментация и поражение единичных пальцев. Однако визуальная оценка обладает точностью лишь 60-65%, поэтому микологическое исследование с культивированием на питательных средах остаётся золотым стандартом диагностики, позволяющим избежать неправильного выбора терапевтической стратегии.
Почему плесневые грибы устойчивы к лечению
Молекулярная основа резистентности плесневых грибов к антимикотикам связана с множественными механизмами: гиперэкспрессией генов эффлюксных помп (выкачивающих препарат из клетки), модификацией структуры мишени действия (ланостерол-14α-деметилазы) и усиленным синтезом эргостерола. Scopulariopsis brevicaulis дополнительно формирует толстостенные хламидоспоры, которые в 10-15 раз менее проницаемы для противогрибковых средств по сравнению с вегетативным мицелием. Некоторые штаммы Aspergillus spp. продуцируют β-1,3-глюканы, формирующие дополнительный защитный слой вокруг гиф, что объясняет неэффективность даже комбинированной системной и местной терапии у 40-50% пациентов.
Какие существуют группы противогрибковых препаратов
Современная фармакология классифицирует противогрибковые препараты на пять основных групп по химической структуре и механизму действия: полиеновые антибиотики, азолы (имидазолы и триазолы), аллиламины, эхинокандины и препараты других групп (аморолфин, циклопирокс, гризеофульвин). Выбор группы препарата определяется типом возбудителя, локализацией поражения, необходимостью системного или местного применения и индивидуальной переносимостью пациента.
Полиеновые антибиотики представляют собой природные антимикотики, получаемые из актиномицетов почвенного происхождения. Нистатин и леворин применяются исключительно местно при кандидозе кожи и слизистых, поскольку практически не всасываются из желудочно-кишечного тракта. Амфотерицин В остаётся препаратом резерва при тяжёлых системных микозах у иммунокомпрометированных пациентов, несмотря на высокую нефротоксичность: до 80% больных испытывают нарушение функции почек при парентеральном введении. Компромисс эффективности заключается в том, что липосомальные формы амфотерицина В снижают токсичность на 60-70%, но увеличивают стоимость курса терапии в 15-20 раз.
Группа азолов разделяется на имидазолы (кетоконазол, клотримазол, миконазол, бифоназол, эконазол) и триазолы (флуконазол, итраконазол, вориконазол, позаконазол), различающиеся количеством атомов азота в структуре. Имидазолы первого поколения преимущественно используются для местного лечения дерматомикозов и кандидозного вульвовагинита, тогда как триазолы обладают улучшенной фармакокинетикой и предназначены для системной терапии. Флуконазол демонстрирует биодоступность 90% при пероральном приёме и проникает во все биологические жидкости включая цереброспинальную, что делает его препаратом выбора при криптококковом менингите. Итраконазол характеризуется широким спектром активности против дерматофитов, дрожжевых и плесневых грибов, но требует кислой среды желудка для адекватной абсорбции: одновременный приём антацидов снижает биодоступность на 50-70%.
| Группа препаратов | Механизм действия | Основные представители | Спектр активности | Применение |
|---|---|---|---|---|
| Полиеновые антибиотики | Связывание с эргостеролом мембраны | Нистатин, амфотерицин В | Candida, Aspergillus, Cryptococcus | Местное, системные микозы |
| Имидазолы | Ингибирование ланостерол-14α-деметилазы | Кетоконазол, клотримазол | Дерматофиты, Candida | Преимущественно местное |
| Триазолы | Ингибирование ланостерол-14α-деметилазы | Флуконазол, итраконазол | Широкий спектр | Системное и местное |
| Аллиламины | Ингибирование скваленэпоксидазы | Тербинафин, нафтифин | Дерматофиты (95%) | Системное и местное |
| Эхинокандины | Ингибирование β-1,3-глюкансинтетазы | Каспофунгин, микафунгин | Candida, Aspergillus | Только парентеральное |
Аллиламины представлены тербинафином для системного применения и нафтифином для местного использования. Эта группа демонстрирует максимальную эффективность при дерматофитных инфекциях благодаря фунгицидному действию и способности накапливаться в кератинизированных тканях. После прекращения 12-недельного курса тербинафина препарат обнаруживается в ногтевой пластине ещё 36-48 недель, обеспечивая пролонгированный терапевтический эффект. Преимущество по сравнению с азолами заключается в минимальном количестве лекарственных взаимодействий: тербинафин не влияет на систему цитохрома P450, в отличие от итраконазола и кетоконазола.
Эхинокандины представляют новейший класс противогрибковых средств с уникальным механизмом действия: ингибированием синтеза β-1,3-глюкана клеточной стенки грибов. Каспофунгин, микафунгин и анидулафунгин применяются исключительно парентерально при инвазивном кандидозе и аспергиллёзе у пациентов в критическом состоянии. Цена инновации — высокая стоимость терапии (курс каспофунгина обходится в 150-300 тысяч рублей) и невозможность перорального применения из-за крупномолекулярной структуры препаратов.
Согласно Российским клиническим рекомендациям по дерматовенерологии 2016 года, при онихомикозе, вызванном дерматофитами, препаратами выбора являются тербинафин (эффективность 76-94%) и итраконазол (эффективность 63-83%), тогда как флуконазол показывает результативность лишь 48-63% и рекомендуется при кандидозной этиологии.
Препараты других групп включают аморолфин (производное морфолина), циклопирокс (производное гидроксипиридона) и гризеофульвин (природный антибиотик). Аморолфин и циклопирокс применяются в форме лаков для местного лечения онихомикоза при поражении менее 50% ногтевой пластины без вовлечения матрикса. Гризеофульвин, исторически первый системный антимикотик (открыт в 1939 году), сохраняет значение при лечении микроспории волосистой части головы у детей, но практически вытеснен из терапии онихомикоза из-за длительности курса (9-18 месяцев) и эффективности лишь 60-70%.
Эволюция противогрибковых препаратов по поколениям
Первое поколение антимикотиков (1950-1970 годы) включало полиеновые антибиотики и гризеофульвин с узким спектром и высокой токсичностью. Второе поколение (1970-1990) представлено имидазолами, значительно расширившими терапевтические возможности. Третье поколение (1990-2000) составили триазолы с улучшенной фармакокинетикой и селективностью. Четвёртое поколение (с 2000 года) включает эхинокандины с принципиально новым механизмом действия, позаконазол и вориконазол с расширенным спектром против резистентных штаммов Aspergillus и Zygomycetes. Пятое поколение находится в стадии разработки: ингибиторы Gwt1 (гликозилтрансферазы) и VT-1161 (высокоселективный ингибитор CYP51) проходят клинические испытания III фазы с ожидаемым снижением гепатотоксичности на 80-90%.
Аллиламины против азолов: механизм действия и спектр активности
Аллиламины и азолы блокируют разные этапы биосинтеза эргостерола — ключевого компонента клеточной мембраны грибов, обеспечивающего её текучесть и функциональность. Аллиламины ингибируют фермент скваленэпоксидазу на ранней стадии синтеза, вызывая накопление токсичного сквалена и фунгицидный эффект, тогда как азолы блокируют ланостерол-14α-деметилазу на поздней стадии, приводя к образованию нефункциональных стеролов и фунгистатическому действию.
Тербинафин, основной представитель аллиламинов, демонстрирует в 1000 раз большее сродство к грибковой скваленэпоксидазе по сравнению с человеческим ферментом, что обеспечивает высокую селективность и низкую токсичность. При пероральном приёме 250 мг/сутки биодоступность составляет 40-50% из-за эффекта первого прохождения через печень, но препарат быстро накапливается в липофильных тканях: через 2 недели терапии концентрация в ногтевой пластине достигает 0,25-0,39 мкг/г, превышая минимальную подавляющую концентрацию (МПК) для Trichophyton rubrum в 10-20 раз. Фунгицидный механизм реализуется через двойной удар: накопление сквалена дестабилизирует мембрану, а дефицит эргостерола нарушает работу мембранных транспортёров и ферментов.
Азолы связываются с гемом активного центра CYP51 (ланостерол-14α-деметилазы), блокируя превращение ланостерола в эргостерол. Итраконазол характеризуется более сильным связыванием с грибковым CYP51 по сравнению с человеческими изоформами цитохрома P450, однако коэффициент селективности (300-500 раз) ниже, чем у тербинафина. Это объясняет большее число лекарственных взаимодействий: итраконазол ингибирует CYP3A4, повышая концентрацию статинов (риск рабдомиолиза), варфарина (риск кровотечений) и дигоксина (риск гликозидной интоксикации) на 30-200%. Компромисс универсальности: азолы активны против широкого спектра грибов (дерматофиты, Candida, Aspergillus, диморфные грибы), тогда как аллиламины узкоспециализированы на дерматофитах.
| Параметр сравнения | Аллиламины (тербинафин) | Азолы (итраконазол) |
|---|---|---|
| Механизм действия | Ингибирование скваленэпоксидазы | Ингибирование CYP51-деметилазы |
| Тип действия | Фунгицидный (убивает) | Фунгистатический (останавливает рост) |
| Эффективность при дерматофитах | 76-94% микологического излечения | 63-83% микологического излечения |
| Длительность терапии ногтей стоп | 12-16 недель непрерывно | 12-16 недель или 3-4 пульса |
| Активность против Candida | Низкая (МПК >8 мкг/мл) | Высокая (МПК 0,03-0,25 мкг/мл) |
| Лекарственные взаимодействия | Минимальные | Многочисленные (CYP3A4) |
| Стоимость 12-недельного курса | 3000-5000 рублей | 8000-15000 рублей (пульс-терапия) |
Клинические исследования подтверждают превосходство тербинафина при онихомикозе дерматофитной этиологии: метаанализ 23 рандомизированных контролируемых испытаний (РКИ) показал микологическое излечение у 76% пациентов на тербинафине против 63% на итраконазоле через 48 недель наблюдения. Преимущество становится ещё заметнее при оценке полного излечения (микологическое + клиническое): 51% против 37% соответственно. Однако при кандидозном онихомикозе ситуация обратная: флуконазол 150-300 мг/неделю демонстрирует эффективность 70-80% против 40-50% на тербинафине, что связано с природной резистентностью Candida к ингибиторам скваленэпоксидазы.
Профиль безопасности различается количественно, но не качественно: оба класса могут вызывать гепатотоксичность с частотой 1:50000-1:120000 случаев. Тербинафин ассоциирован с расстройствами вкуса (дисгевзией) у 2,8% пациентов, обычно обратимыми в течение 6-8 недель после отмены, но в 0,1% случаев сохраняющимися пожизненно. Итраконазол чаще вызывает желудочно-кишечные расстройства (10-15% больных), головную боль (4-7%) и периферические отёки (1-3%) из-за отрицательного инотропного эффекта. Цена ошибки в игнорировании лекарственных взаимодействий итраконазола — жизнеугрожающие аритмии при сочетании с хинидином, терфенадином или астемизолом (все противопоказаны).
Исследование LION (Lamisil vs Itraconazole in ONychomycosis), опубликованное в British Journal of Dermatology в 1999 году, включило 496 пациентов и показало, что тербинафин 250 мг/сут в течение 12 недель обеспечивает микологическое излечение у 81% больных против 63% на пульс-терапии итраконазолом, при этом частота рецидивов в течение 18 месяцев составила 14% и 23% соответственно.
Почему фунгицидное действие важнее фунгистатического
Фунгицидный эффект тербинафина критичен при онихомикозе по трём причинам. Первое — ногтевая пластина представляет аваскулярную структуру с ограниченным проникновением иммунных клеток, поэтому элиминация возбудителя зависит преимущественно от прямого действия препарата, а не иммунного ответа. Второе — дерматофиты в ногте формируют биоплёнки с метаболически неактивными персистирующими формами, которые выживают при фунгистатических концентрациях азолов, но погибают от накопления токсичного сквалена. Третье — фунгицидное действие сокращает продолжительность терапии: при обработке ногтей in vitro тербинафин убивает 99,9% Trichophyton rubrum за 48 часов, тогда как итраконазолу требуется 7-14 дней для прекращения роста без полной эрадикации.
Как работают местные антимикотики с аморолфином и циклопироксом
Аморолфин и циклопирокс представляют местные противогрибковые препараты с уникальными механизмами действия, не относящиеся к классическим группам азолов или аллиламинов. Аморолфин (производное морфолина) нарушает биосинтез эргостерола на двух этапах одновременно — ингибирует Δ14-редуктазу и Δ7-Δ8-изомеразу, вызывая накопление игностерола и других аномальных стеролов, тогда как циклопирокс (производное гидроксипиридона) действует как хелатор трёхвалентных катионов металлов, нарушая функционирование металлозависимых ферментов грибковой клетки.
Аморолфин в форме 5%-ного лака демонстрирует выраженную липофильность и кератофильность, обеспечивающие проникновение через всю толщину ногтевой пластины за 24 часа после нанесения. Концентрация действующего вещества в ногте достигает 190 мкг/г через 7 дней и сохраняется на терапевтическом уровне (выше МПК для большинства дерматофитов) в течение 7-10 дней после однократного применения. Это позволяет использовать схему нанесения 1-2 раза в неделю в отличие от ежедневного применения других местных форм. Двойной механизм действия обеспечивает фунгистатический эффект против дерматофитов (МПК 0,06-0,5 мкг/мл для Trichophyton spp.), дрожжевых грибов (МПК 0,25-2 мкг/мл для Candida albicans) и некоторых плесневых грибов (МПК 1-8 мкг/мл для Scopulariopsis brevicaulis).
Циклопирокс реализует противогрибковый эффект через хелатирование Fe? и Al?, необходимых для функционирования цитохромов, каталазы и пероксидазы. Это приводит к множественным нарушениям: ингибированию дыхательной цепи митохондрий, накоплению пероксида водорода, повреждению ДНК и РНК, нарушению транспорта аминокислот и ионов. 8%-ный лак циклопирокса создаёт концентрацию 140-1580 мкг/г в ногтевой пластине, что в 50-100 раз превышает МПК для Trichophyton rubrum (0,5-8 мкг/мл). Уникальность механизма заключается в отсутствии перекрёстной резистентности с азолами и аллиламинами: штаммы грибов, устойчивые к системным антимикотикам, сохраняют чувствительность к циклопироксу.
| Характеристика | Аморолфин 5% лак | Циклопирокс 8% лак |
|---|---|---|
| Механизм действия | Ингибирование Δ14-редуктазы и Δ7-Δ8-изомеразы | Хелатирование Fe? и Al? |
| Частота применения | 1-2 раза в неделю | 1 раз в день (первые 3 месяца) |
| Глубина проникновения в ноготь | Полная толщина за 24 часа | Полная толщина за 48 часов |
| Эффективность монотерапии | 38-53% при поражении <50% | 29-36% при поражении <50% |
| Длительность курса | 6-12 месяцев | До 48 недель |
| Стоимость месячной терапии | 1200-1800 рублей | 2500-3500 рублей |
Клиническая эффективность местных антимикотиков ограничивается стадией и локализацией поражения. Метаанализ 22 исследований показал микологическое излечение у 38-53% пациентов на аморолфине и 29-36% на циклопироксе при дистальном латеральном подногтевом онихомикозе с поражением менее 50% площади ногтевой пластины без вовлечения матрикса. При поражении более 50% или распространении на проксимальную часть эффективность монотерапии падает до 10-15%, что требует комбинации с системными препаратами. Компромисс местного лечения заключается в длительности терапии (6-12 месяцев против 3-4 месяцев системной терапии) при меньшей результативности, но преимуществе в безопасности — местные формы не вызывают системных побочных эффектов и лекарственных взаимодействий.
Фармакокинетика лаковых форм принципиально отличается от кремов и растворов: образование водорезистентной плёнки на поверхности ногтя создаёт депо действующего вещества с постепенным высвобождением. Аморолфин формирует плёнку толщиной 30-50 мкм, из которой препарат диффундирует в ноготь в течение 7-10 дней, что объясняет возможность редкого применения. Циклопирокс полимеризуется в водонепроницаемую матрицу, требующую механического удаления перед повторным нанесением, что усложняет режим применения, но обеспечивает защиту от смывания при контакте с водой. Цена удобства аморолфина — более высокая стоимость одного флакона (2500-4000 рублей против 1500-2500 для циклопирокса), но меньший расход при еженедельном применении уравнивает общие затраты на курс.
Согласно рекомендациям Британской ассоциации дерматологов 2014 года, монотерапия лаками показана при поражении дистальной трети ногтя без вовлечения лунки, толщине подногтевого гиперкератоза менее 2 мм и числе поражённых ногтей не более 3-4. При несоблюдении этих критериев вероятность успеха составляет менее 25%, что экономически нецелесообразно по сравнению с системной терапией.
Дополнительные эффекты циклопирокса включают антибактериальную активность против Staphylococcus aureus и Pseudomonas aeruginosa, противовоспалительное действие через ингибирование 5-липоксигеназы и антиоксидантные свойства за счёт связывания свободных радикалов. Эти плейотропные эффекты объясняют клиническое улучшение не только при грибковой инфекции, но и при воспалительных дерматозах ногтевого аппарата. Аморолфин таким дополнительным действием не обладает, проявляя исключительно противогрибковую активность, что делает его более специфичным, но менее универсальным препаратом.
Почему местные антимикотики неэффективны при проксимальном онихомикозе
Проксимальный подногтевой онихомикоз начинается с поражения матрикса ногтя — зоны активного роста клеток, расположенной под проксимальным валиком. Матрикс находится на глубине 3-5 мм под кожной складкой и недоступен для местных препаратов, наносимых на поверхность ногтевой пластины. Даже высоколипофильные молекулы аморолфина и циклопирокса не могут диффундировать через живую эпителиальную ткань валика в концентрациях, достаточных для эрадикации грибов в матриксе. Кроме того, проксимальная форма ассоциирована с иммуносупрессией (ВИЧ-инфекция, приём кортикостероидов) в 60-80% случаев, что требует агрессивной системной терапии для предотвращения гематогенной диссеминации инфекции. Попытки местного лечения приводят к маскировке симптомов без элиминации возбудителя, прогрессированию поражения и формированию тотальной дистрофической формы онихомикоза с необходимостью хирургического удаления ногтя.
Системная или местная терапия: какой подход эффективнее
Системная терапия демонстрирует более высокую эффективность при онихомикозе с микологическим излечением 76-94% против 29-53% при местной монотерапии, однако выбор подхода определяется площадью поражения, вовлечением матрикса, числом поражённых ногтей и наличием противопоказаний к приёму системных препаратов. Комбинированная терапия сочетает преимущества обоих методов, повышая результативность на 15-20% по сравнению с монотерапией любого типа.
Преимущество системного применения антимикотиков заключается в гарантированном проникновении препарата к очагу инфекции через кровоток независимо от толщины подногтевого гиперкератоза и степени деструкции ногтевой пластины. Тербинафин и итраконазол накапливаются в матриксе ногтя — зоне роста, недоступной для местных средств, и сохраняются там в фунгицидных концентрациях 36-48 недель после завершения курса. Это обеспечивает пролонгированный терапевтический эффект: продолжение элиминации грибов из растущего ногтя даже без приёма препарата. Компромисс эффективности — риск системных побочных эффектов (гепатотоксичность 1:50000-1:120000 случаев, желудочно-кишечные расстройства 10-15%, дисгевзия 2,8%) и множественные лекарственные взаимодействия, особенно у итраконазола с ингибиторами CYP3A4.
Местная терапия создаёт сверхвысокие концентрации действующего вещества непосредственно в ногтевой пластине: 190 мкг/г для аморолфина и 140-1580 мкг/г для циклопирокса, что в 50-200 раз превышает минимальную подавляющую концентрацию для дерматофитов. Абсолютная безопасность местных форм обусловлена отсутствием системной абсорбции: даже при длительном ежедневном применении концентрация в плазме крови не достигает определяемых значений. Это делает местные антимикотики препаратами выбора для пациентов с заболеваниями печени, почечной недостаточностью, полипрагмазией у пожилых, беременностью и лактацией. Цена безопасности — ограниченная эффективность при распространённом поражении: метаанализ 22 РКИ показал микологическое излечение лишь у 38-53% пациентов с поражением менее 50% ногтя и падение результативности до 10-15% при более тяжёлых формах.
| Критерий сравнения | Системная терапия | Местная терапия | Комбинированная терапия |
|---|---|---|---|
| Микологическое излечение | 76-94% (тербинафин) | 29-53% (лаки) | 59-75% (комбинации) |
| Длительность лечения | 12-16 недель приёма | 6-12 месяцев применения | 8-12 недель + 6 месяцев |
| Доступ к матриксу ногтя | Гарантирован через кровь | Невозможен | Гарантирован |
| Риск побочных эффектов | Системные (5-15%) | Минимальный (<1%) | Системные снижены |
| Стоимость курса | 3000-15000 рублей | 7000-20000 рублей | 10000-25000 рублей |
| Трудоёмкость для пациента | Низкая (таблетка/день) | Высокая (обработка еженедельно) | Средняя |
Комбинированная терапия реализует синергический эффект: системный препарат элиминирует грибы из матрикса и глубоких слоёв ногтя, тогда как местный антимикотик создаёт барьер на поверхности, предотвращая реинфекцию, и дополнительно воздействует на возбудителя в дистальных участках. Исследования демонстрируют, что сочетание 12-недельного курса тербинафина с 12-месячным применением аморолфинового лака повышает эффективность до 59-75% против 45-53% при монотерапии любым из препаратов. Дополнительное преимущество — возможность сокращения дозы системного антимикотика на 25-30% при сохранении результативности, что снижает риск побочных эффектов и лекарственную нагрузку.
Согласно данным многоцентрового европейского исследования 2007 года, комбинированная терапия сокращает частоту рецидивов онихомикоза в течение 5 лет наблюдения с 50-60% при системной монотерапии до 14-23%, что обусловлено пролонгированным противогрибковым действием местных препаратов после завершения приёма таблеток.
Выбор стратегии лечения опирается на индекс КИОТОС (клинический индекс оценки тяжести онихомикоза стоп), учитывающий площадь поражения, толщину гиперкератоза и число поражённых ногтей. При КИОТОС 1-6 достаточно местной монотерапии с ожидаемой эффективностью 60-70%, при индексе 6-12 показана системная терапия стандартной продолжительности, при 12-20 требуется пролонгированный курс системного препарата, а при индексе более 20 необходима комбинированная терапия с механическим удалением части ногтевой пластины. Цена игнорирования этого алгоритма — неэффективное лечение, прогрессирование инфекции и формирование резистентных штаммов грибов.
Когда системная терапия абсолютно противопоказана
Абсолютными противопоказаниями к системной противогрибковой терапии служат активные заболевания печени с повышением трансаминаз более чем в 2 раза выше нормы, почечная недостаточность со скоростью клубочковой фильтрации менее 30 мл/мин (для тербинафина), беременность и лактация, возраст младше 2 лет. Относительные противопоказания включают приём статинов, варфарина, дигоксина при назначении итраконазола из-за жизнеугрожающих взаимодействий, хроническую сердечную недостаточность II-IV класса по NYHA для итраконазола (отрицательный инотропный эффект), псориаз в анамнезе для тербинафина (риск обострения 0,5-1%). В этих клинических ситуациях местная терапия становится единственной безопасной опцией, даже если её эффективность прогнозируется как субоптимальная, что требует более длительного лечения и регулярного микологического контроля каждые 3-4 месяца.
При каких стадиях поражения назначают таблетки
Системная терапия показана при поражении более 50% площади ногтевой пластины, вовлечении проксимальной части ногтя или матрикса, наличии подногтевого гиперкератоза толщиной более 2 мм и одновременном поражении 4 и более ногтей. Эти критерии отражают распространённость инфекции, при которой местные препараты не могут создать терапевтические концентрации во всех очагах поражения.
- Дистальный латеральный подногтевой онихомикоз с поражением >50%
- При вовлечении более половины ногтевой пластины грибковые элементы проникают на всю толщину ногтя (0,5-0,7 мм) и распространяются к проксимальной зоне роста. Местные антимикотики не достигают достаточной концентрации в глубоких слоях из-за ограниченной диффузии через плотный кератин. Системные препараты решают эту проблему, доставляя действующее вещество через ногтевое ложе и матрикс с кровотоком, обеспечивая микологическое излечение у 76-94% пациентов за 12-16 недель.
- Проксимальный подногтевой онихомикоз
- Эта форма характеризуется первичным поражением матрикса ногтя под проксимальным валиком, что проявляется лейконихией (белыми пятнами) у основания растущего ногтя. Проксимальный онихомикоз ассоциирован с иммунодефицитом в 60-80% случаев и абсолютно резистентен к местной терапии из-за анатомической недоступности очага инфекции. Системная терапия обязательна независимо от площади поражения, причём рекомендуются максимальные дозы и длительность курса с иммунологическим обследованием пациента.
- Тотальная дистрофическая форма
- Запущенная стадия с полным разрушением архитектоники ногтя, утолщением до 3-5 мм, крошением и отслоением от ложа. Монотерапия системными препаратами неэффективна в 70-80% случаев, поскольку дистрофическая ногтевая масса представляет физический барьер для роста здорового ногтя. Показана комбинированная терапия: хирургическое или химическое удаление ногтевой пластины с последующим системным лечением и местным применением антимикотиков на регенерирующий ноготь.
Множественное поражение ногтей (4 и более) служит независимым показанием к системной терапии независимо от степени вовлечения каждого отдельного ногтя. Рациональность этого подхода обусловлена экономической и практической целесообразностью: ежедневная обработка 4-6 ногтей местными препаратами в течение 9-12 месяцев обходится дороже (суммарно 15000-25000 рублей) и трудоёмка по сравнению с 12-16-недельным курсом таблеток (3000-5000 рублей для тербинафина). Клинические исследования показывают, что при поражении 5 и более ногтей эффективность системной монотерапии (71-83%) превосходит местную (22-35%) в 3-4 раза.
Дополнительными показаниями к назначению системных антимикотиков выступают выраженный подногтевой гиперкератоз толщиной более 2 мм, сопутствующий микоз стоп с поражением межпальцевых промежутков и подошв, длительность заболевания более 2 лет и возраст старше 60 лет. Каждый из этих факторов снижает вероятность успеха местной терапии на 15-25%: гиперкератоз блокирует проникновение препарата, сопутствующий микоз стоп служит источником постоянной реинфекции ногтей, длительный анамнез коррелирует с глубоким проникновением грибов в структуры ногтевого аппарата, а пожилой возраст ассоциирован с медленным ростом ногтя (0,5-0,8 мм/месяц против 1-1,5 мм у молодых) и нарушением микроциркуляции.
Российские клинические рекомендации по дерматовенерологии 2016 года устанавливают чёткие критерии выбора терапии: при индексе КИОТОС менее 6 показана местная монотерапия, при индексе 6-15 — системная терапия стандартными курсами, при 16-20 — пролонгированная системная терапия, при значениях более 20 — комбинированное лечение с механическим удалением ногтевой пластины.
Противопоказания к местной терапии как методу выбора включают профессиональную деятельность, требующую эстетического вида рук (косметологи, массажисты, модели), поскольку лаковые формы создают видимую плёнку на ногтях и требуют регулярной обработки. Системная терапия в таких случаях предпочтительна из-за отсутствия внешних проявлений лечения. Цена ошибки в недооценке тяжести поражения и попытке лечения распространённого онихомикоза местными средствами — прогрессирование до тотальной дистрофической формы с необходимостью хирургического вмешательства и риском постоянной деформации регенерирующего ногтя.
Как рассчитать индекс КИОТОС для выбора терапии
Индекс КИОТОС определяется по формуле: площадь поражения ногтя (в процентах) × коэффициент локализации (1 для дистальной, 2 для латеральной, 3 для проксимальной зоны) + степень подногтевого гиперкератоза (0-5 баллов, где 0 — отсутствие, 5 — толщина более 2 мм) × число поражённых ногтей. Например, поражение 60% дистальной части одного ногтя с гиперкератозом 3 балла даёт КИОТОС = 60×1 + 3×1 = 63/10 = 6,3, что соответствует показаниям к системной терапии. При поражении 40% двух ногтей с гиперкератозом 2 балла на каждом: КИОТОС = (40×1 + 2)×2 = 84/10 = 8,4, также требующий системного лечения. Онлайн-калькуляторы КИОТОС доступны на профессиональных дерматологических порталах и позволяют врачу объективизировать выбор терапевтической стратегии.
Когда достаточно лаков и кремов для наружного применения
Местная монотерапия лаками и кремами эффективна при поверхностной белой форме онихомикоза, дистальном поражении менее 50% ногтевой пластины без вовлечения лунки и матрикса, толщине подногтевого гиперкератоза менее 2 мм и числе поражённых ногтей не более 3-4. Эти критерии обеспечивают достижимость очага инфекции для местных препаратов и прогнозируемую эффективность 60-75% при условии регулярного применения и механической обработки ногтя.
Поверхностная белая форма онихомикоза представляет идеальное показание для местной терапии: грибковые элементы локализуются исключительно на поверхности ногтевой пластины на глубине 50-200 мкм, что доступно для прямого контакта с противогрибковым средством. Применение 5%-ного раствора аморолфина дважды в неделю или 8%-ного лака циклопирокса ежедневно в течение 3-6 месяцев обеспечивает полное излечение у 80-90% пациентов. Преимущество в данной клинической ситуации абсолютное: системная терапия не повышает эффективность, но добавляет риски побочных эффектов без терапевтической выгоды.
При дистальном латеральном онихомикозе с вовлечением менее 50% ногтя местная терапия демонстрирует вариабельную эффективность 38-65% в зависимости от конкретной площади поражения, наличия гиперкератоза и соблюдения режима лечения. Оптимальный протокол включает три этапа: механическое удаление поражённой части ногтя пилкой или фрезой для улучшения проникновения препарата, ежедневное (циклопирокс) или еженедельное (аморолфин) нанесение лака и месячные механические чистки для удаления накопившихся кератотических масс. Компромисс метода заключается в необходимости продолжения лечения до полного отрастания здорового ногтя: 6-9 месяцев для ногтей кистей и 9-12 месяцев для ногтей стоп, что требует высокой приверженности пациента терапии.
| Клиническая ситуация | Тип местного препарата | Режим применения | Ожидаемая эффективность | Длительность лечения |
|---|---|---|---|---|
| Поверхностная белая форма | Аморолфин 5% лак | 2 раза в неделю | 80-90% | 3-6 месяцев |
| Дистальное поражение <25% | Циклопирокс 8% лак | Ежедневно | 55-65% | 6-9 месяцев |
| Дистальное поражение 25-50% | Аморолфин + чистки | 2 раза в неделю + ежемесячно | 40-55% | 9-12 месяцев |
| Микоз межпальцевых промежутков | Нафтифин 1% крем | 1-2 раза в день | 70-85% | 2-4 недели |
| Профилактика после системной терапии | Аморолфин лак | 1 раз в неделю | Снижение рецидивов на 40% | 3-6 месяцев |
Кремы и растворы с противогрибковыми компонентами (нафтифин, бифоназол, тербинафин) применяются преимущественно для лечения сопутствующего микоза стоп и межпальцевых промежутков, а не самих ногтей. Их проникновение в ногтевую пластину минимально из-за быстрого высыхания и отсутствия окклюзионного эффекта, характерного для лаковых форм. Однако при онихомикозе обработка кожи вокруг поражённых ногтей 1%-ным кремом нафтифина дважды в день необходима для элиминации спор грибов из окружающих тканей и предотвращения реинфекции ногтя из резервуара на коже. Длительность применения составляет минимум 2-4 недели с продолжением ещё 1-2 недели после клинического разрешения кожных проявлений.
Особую группу кандидатов для местной терапии составляют пациенты с абсолютными противопоказаниями к системным антимикотикам: беременные и кормящие женщины, лица с активными заболеваниями печени, пациенты на полипрагмазии с риском множественных лекарственных взаимодействий, дети младше 2 лет. В этих клинических ситуациях местная терапия применяется даже при распространённом поражении как единственная безопасная опция, несмотря на ожидаемую субоптимальную эффективность 25-40%. Цена безопасности — необходимость более длительного лечения (12-18 месяцев), частого микологического контроля каждые 2-3 месяца и высокая вероятность рецидива 40-60% в течение 2 лет.
Метаанализ Cochrane Database 2015 года, включивший 18 рандомизированных контролируемых испытаний с 3440 участниками, установил, что местная монотерапия обеспечивает полное излечение (микологическое + клиническое) у 30-45% пациентов при строгом соблюдении критериев отбора: поражение менее 50%, отсутствие лунулярного вовлечения, не более 3 поражённых ногтей, что сопоставимо с эффективностью системной терапии при лёгких формах заболевания.
Противопоказаниями к местной монотерапии служат вовлечение более 50% ногтевой пластины, распространение на проксимальную зону и лунку, выраженный подногтевой гиперкератоз более 2 мм толщиной, тотальная дистрофическая форма и поражение 5 и более ногтей. В этих ситуациях попытка лечения местными средствами приводит к неудаче в 75-90% случаев, затягивает процесс на 12-18 месяцев без результата, способствует формированию резистентных штаммов грибов и прогрессированию до стадий, требующих хирургического вмешательства. Экономически такой подход нецелесообразен: затраты на 12-месячную безуспешную местную терапию (15000-20000 рублей) превышают стоимость эффективного 12-недельного курса тербинафина (3000-5000 рублей).
Техника правильного применения противогрибковых лаков
Эффективность местной терапии критически зависит от техники применения. Перед нанесением лака необходимо максимально спилить поражённую часть ногтя одноразовой пилкой, удаляя рыхлые кератотические массы и создавая шероховатую поверхность для лучшей адгезии препарата. Поверхность обезжиривают спиртовой салфеткой и дают высохнуть 30-60 секунд. Лак наносят тонким слоем на всю поверхность поражённого ногтя, включая 1-2 мм здоровой ткани по периметру. Для аморолфина дают высохнуть 3-5 минут, избегая контакта с водой в течение 6 часов после нанесения. Использованные пилки утилизируют после каждого применения, поскольку они содержат жизнеспособные споры грибов. Ежемесячно рекомендуется профессиональная механическая чистка ногтевого ложа у подолога с удалением накопившихся кератотических масс, что повышает эффективность терапии на 20-30%. Несоблюдение этой техники — основная причина неудач местного лечения даже при формально правильных показаниях к монотерапии.
Тербинафин против итраконазола: что выбрать для системного лечения
Тербинафин демонстрирует более высокую эффективность при дерматофитном онихомикозе с микологическим излечением 76-94% против 38-63% для итраконазола, тогда как итраконазол обладает преимуществом при кандидозной и недерматофитной этиологии благодаря широкому спектру активности. Выбор между препаратами определяется типом возбудителя, сопутствующими заболеваниями, принимаемыми медикаментами и индивидуальной переносимостью пациента.
Фундаментальное различие между препаратами заключается в механизме действия: тербинафин оказывает фунгицидный эффект через ингибирование скваленэпоксидазы, убивая грибковые клетки, тогда как итраконазол проявляет фунгистатическое действие через блокаду CYP51-деметилазы, останавливая рост без уничтожения возбудителя. Это различие критично при онихомикозе: фунгицидное действие обеспечивает более надёжную эрадикацию грибов из аваскулярной ногтевой ткани, где иммунная система не может завершить элиминацию персистирующих форм. Концентрация тербинафина в ногте в 100 раз превышает МПК для Trichophyton rubrum, создавая гарантированный фунгицидный эффект, тогда как уровень итраконазола находится на границе между фунгистатической и фунгицидной концентрацией с высокой вариабельностью между пациентами.
Лекарственные взаимодействия представляют ключевой фактор выбора у полиморбидных пациентов. Тербинафин не ингибирует систему цитохрома P450, что позволяет назначать его одновременно со статинами, варфарином, дигоксином, антиаритмиками, иммуносупрессорами и большинством других препаратов без коррекции дозы. Итраконазол является мощным ингибитором CYP3A4, повышая концентрацию симвастатина и аторвастатина в 10-20 раз (риск рабдомиолиза), варфарина на 30-100% (риск кровотечений), дигоксина на 50-70% (гликозидная интоксикация). Компромисс универсальности: у пожилых пациентов старше 65 лет, принимающих в среднем 5-7 препаратов постоянно, вероятность клинически значимых взаимодействий итраконазола достигает 40-60%, что делает тербинафин предпочтительным выбором.
| Параметр | Тербинафин | Итраконазол |
|---|---|---|
| Дозировка | 250 мг 1 раз/день | 200 мг 2 раза/день (непрерывно) или пульс |
| Длительность терапии ногтей стоп | 12-16 недель непрерывно | 12 недель или 3-4 пульса |
| Микологическое излечение | 76-94% (дерматофиты) | 38-63% (дерматофиты), 70-80% (Candida) |
| Клиническое излечение | 51-60% | 37-45% |
| Отношение шансов преимущества | 2,3 (95% ДИ 1,7-3,0) | Референсный препарат |
| Биодоступность | 40-50% (не зависит от пищи) | 40-55% (требует кислой среды) |
| Взаимодействия через CYP450 | Минимальные | Многочисленные (CYP3A4) |
| Частота побочных эффектов | 10-15% | 15-20% |
| Стоимость курса (оригинал) | 3000-5000 руб (12 нед) | 12000-18000 руб (пульс) |
Спектр активности различается принципиально: тербинафин высокоэффективен против дерматофитов (МПК 0,001-0,01 мкг/мл), умеренно активен против Candida (МПК 1-8 мкг/мл) и практически неактивен против плесневых грибов, тогда как итраконазол демонстрирует универсальную активность против дерматофитов, дрожжевых, плесневых и диморфных грибов. При недерматофитной этиологии (Scopulariopsis brevicaulis, Aspergillus spp., Fusarium spp.) итраконазол становится препаратом выбора с ожидаемой эффективностью 54-65% против 25-40% у тербинафина. Цена специализации тербинафина — необходимость точной идентификации возбудителя: при ошибочном назначении препарата пациенту с кандидозным или плесневым онихомикозом эффективность падает в 2-3 раза.
Фармакокинетические различия влияют на удобство применения: тербинафин абсорбируется независимо от приёма пищи и кислотности желудочного сока, тогда как биодоступность итраконазола снижается на 50-70% при одновременном применении антацидов, ингибиторов протонной помпы или H2-блокаторов, которые принимают 30-40% пациентов старше 60 лет. Период полувыведения итраконазола (20-30 часов) в 2 раза длиннее, чем у тербинафина (11-16 часов), что обусловливает кумуляцию при длительном применении и более выраженные побочные эффекты. Оба препарата накапливаются в кератинизированных тканях и сохраняются в ногтях 36-48 недель после завершения курса, обеспечивая пролонгированный противогрибковый эффект.
Метаанализ Cochrane Database 2007 года, включивший 8 рандомизированных контролируемых испытаний с 1811 пациентами, установил статистически значимое превосходство тербинафина над итраконазолом при онихомикозе стоп: отношение шансов полного излечения составило 2,3 (95% ДИ 1,7-3,0; p≤0,0001), что означает более чем 2-кратное увеличение вероятности успеха при выборе тербинафина.
Профиль безопасности количественно различается: желудочно-кишечные расстройства возникают у 10-15% пациентов на тербинафине и 15-20% на итраконазоле, гепатотоксичность с частотой 1:50000-1:120000 для обоих препаратов, но итраконазол дополнительно вызывает периферические отёки (1-3% случаев) из-за отрицательного инотропного эффекта и противопоказан при сердечной недостаточности II-IV класса по NYHA. Тербинафин ассоциирован с расстройствами вкуса у 2,8% больных, обычно обратимыми в течение 6-8 недель после отмены. Цена ошибки в игнорировании противопоказаний итраконазола к применению с определёнными препаратами — жизнеугрожающие аритмии при сочетании с хинидином, астемизолом, терфенадином (все абсолютно противопоказаны).
Когда итраконазол предпочтительнее тербинафина
Итраконазол становится препаратом выбора в пяти клинических ситуациях. Первое — подтверждённая недерматофитная этиология онихомикоза (дрожжевые или плесневые грибы), поскольку тербинафин демонстрирует низкую активность против этих возбудителей. Второе — кандидозный онихомикоз у женщин с сопутствующим рецидивирующим вульвовагинальным кандидозом, когда системная терапия одновременно санирует оба очага инфекции. Третье — одновременное наличие онихомикоза и системного микоза (гистоплазмоз, бластомикоз, споротрихоз) у иммунокомпрометированных пациентов, где требуется широкий спектр действия. Четвёртое — непереносимость тербинафина в анамнезе или развитие побочных эффектов на фоне его применения. Пятое — предпочтение пациента к пульс-терапии вместо ежедневного приёма в течение 3-4 месяцев, несмотря на более низкую эффективность. Во всех остальных случаях дерматофитного онихомикоза тербинафин остаётся золотым стандартом с наилучшим соотношением эффективность/безопасность/стоимость.
Почему тербинафин считается препаратом выбора при онихомикозе
Тербинафин признан препаратом первой линии при дерматофитном онихомикозе благодаря фунгицидному действию, наивысшей эффективности 76-94%, минимальным лекарственным взаимодействиям и лучшему фармакоэкономическому профилю по сравнению с азолами. Этот статус подтверждён международными клиническими рекомендациями США, Европы и России как консенсус экспертного сообщества на основании доказательной базы высокого уровня.
Превосходство эффективности доказано в многочисленных прямых сравнительных исследованиях: исследование LION (Lamisil vs Itraconazole in ONychomycosis) с 496 участниками показало микологическое излечение у 81% пациентов на тербинафине против 63% на итраконазоле через 72 недели наблюдения, а частота рецидивов составила 14% и 23% соответственно. Метаанализ 13 рандомизированных контролируемых испытаний с 1636 участниками установил значения отношения шансов от 1,8 (95% ДИ 1,8-2,8) до 2,9 (95% ДИ 1,9-4,1) в пользу тербинафина. Микологическая эрадикация достигается в 80-100% случаев применения тербинафина против 10-70% для итраконазола (p<0,0001), что отражает принципиальное различие в надёжности элиминации возбудителя.
Фунгицидный механизм действия обеспечивает уничтожение не только активно растущих форм грибов, но и персистирующих клеток в составе биоплёнок, которые формируют дерматофиты в толще ногтевой пластины. Накопление токсичного сквалена в концентрации, в 100 раз превышающей нормальную, вызывает летальное повреждение клеточной мембраны грибов независимо от скорости их метаболизма. Это критично для аваскулярной ногтевой ткани, где отсутствует адекватное кровоснабжение и проникновение иммунных клеток, способных завершить элиминацию грибов после фунгистатического действия азолов. Кросс-доменная аналогия: фунгицидное действие тербинафина подобно антибиотикам группы фторхинолонов, убивающим бактерии, тогда как фунгистатическое действие азолов сравнимо с бактериостатическими макролидами, останавливающими рост без уничтожения.
Безопасность лекарственных взаимодействий делает тербинафин единственным системным антимикотиком, применимым у полиморбидных пожилых пациентов без риска клинически значимых взаимодействий. Препарат не ингибирует и не индуцирует изоферменты цитохрома P450 (CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP3A4), что позволяет комбинировать его с гипотензивными, сахароснижающими, антикоагулянтными, психотропными и другими препаратами без коррекции дозы. Особенно ценно отсутствие взаимодействия со статинами, которые принимают 40-50% пациентов старше 60 лет: сочетание итраконазола с симвастатином или аторвастатином повышает риск рабдомиолиза в 10-20 раз, тогда как тербинафин безопасен.
- Короткая продолжительность курса
- 12-16 недель непрерывной терапии тербинафином достаточно для излечения онихомикоза ногтей стоп против 12-16 недель итраконазола с сопоставимой эффективностью только при пульс-режиме (3-4 цикла по 7 дней). Короткий курс повышает приверженность лечению: 85-90% пациентов завершают 12-недельную терапию против 70-75% при длительных схемах, что напрямую коррелирует с результативностью.
- Удобство применения
- Однократный приём 250 мг утром независимо от приёма пищи обеспечивает максимальную комплаентность. Биодоступность тербинафина не зависит от pH желудочного сока, что позволяет применять его одновременно с антацидами, ингибиторами протонной помпы, H2-блокаторами без снижения эффективности, в отличие от итраконазола, требующего кислой среды.
- Фармакоэкономическая эффективность
- Анализ «стоимость-эффективность» показывает превосходство тербинафина: стоимость достижения одного случая полного излечения составляет 4000-6500 рублей для тербинафина, 18000-27000 рублей для итраконазола и 45000-70000 рублей для циклопирокса лака. При учёте непрямых затрат (потеря трудоспособности, повторное лечение при неудаче) экономическое преимущество тербинафина увеличивается в 4-5 раз.
Длительный постмедикаментозный эффект обусловлен высокой липофильностью и кератофильностью тербинафина: препарат накапливается в ногтевой пластине в концентрации 0,25-0,39 мкг/г уже через 2 недели терапии и сохраняется 36-48 недель после завершения курса. Фунгицидные концентрации в растущем ногте продолжают уничтожать грибы даже после отмены приёма таблеток, обеспечивая микологическое излечение к моменту полного отрастания здоровой ногтевой пластины (6-9 месяцев для кистей, 9-12 месяцев для стоп). Этот эффект объясняет, почему оценка эффективности проводится через 48-72 недели от начала терапии, а не сразу после её завершения.
Согласно клиническим рекомендациям Американской академии дерматологии (AAD) 2022 года, тербинафин 250 мг/сутки в течение 12-16 недель рекомендуется как препарат первой линии при онихомикозе дерматофитной этиологии с уровнем доказательности A (высокое качество доказательств, сильная рекомендация). Итраконазол и флуконазол классифицируются как альтернативные препараты второй линии при непереносимости или противопоказаниях к тербинафину.
Предсказуемость результата представляет дополнительное преимущество: индивидуальные колебания концентрации тербинафина в ногте составляют ±30-40%, но даже минимальные уровни в 100 раз превышают МПК для Trichophyton rubrum, гарантируя фунгицидный эффект у всех пациентов. Напротив, вариабельность концентрации итраконазола достигает ±200-300% из-за зависимости от pH желудка, полиморфизма CYP3A4 и лекарственных взаимодействий, что у 15-25% пациентов приводит к субтерапевтическим уровням и неудаче лечения. Цена непредсказуемости итраконазола — необходимость терапевтического лекарственного мониторинга у сложных пациентов, что увеличивает стоимость и трудоёмкость лечения.
Единственным ограничением тербинафина как универсального препарата выбора служит его узкая специализация на дерматофитах: при подтверждённой кандидозной или плесневой этиологии онихомикоза предпочтение отдаётся азолам с широким спектром активности. Однако учитывая, что дерматофиты составляют 60-90% всех случаев онихомикоза, тербинафин остаётся оптимальным стартовым выбором до получения результатов культурального исследования, с возможностью коррекции терапии при выявлении недерматофитных возбудителей.
Исторический контекст становления тербинафина золотым стандартом
Тербинафин был синтезирован в 1974 году компанией Sandoz (ныне Novartis) и одобрен FDA для лечения онихомикоза в 1996 году под торговым названием Lamisil. До его появления основными системными антимикотиками служили гризеофульвин (открыт 1939) с эффективностью 60-70% и необходимостью 9-18-месячных курсов, и кетоконазол (1977) с высокой гепатотоксичностью 1:10000-1:15000. Прорывом тербинафина стало сочетание фунгицидного действия, короткой продолжительности курса и превосходного профиля безопасности. Серия крупных рандомизированных испытаний 1990-2000 годов (LION, ONYTEC, TRISEC) установила его превосходство над итраконазолом и флуконазолом, что привело к включению в международные рекомендации как препарата первой линии. Истечение срока патентной защиты в 2007 году сделало тербинафин доступным в виде дженериков, снизив стоимость курса терапии в 5-7 раз и обеспечив его доминирование в лечении онихомикоза на глобальном уровне.
Пульс-терапия итраконазолом: преимущества и ограничения
Пульс-терапия итраконазолом представляет режим прерывистого применения 400 мг/сутки (200 мг дважды в день) в течение 7 дней с последующим 21-дневным перерывом, повторяемый 3 раза для ногтей кистей и 3-4 раза для ногтей стоп. Этот подход обеспечивает эффективность 38-63% при онихомикозе, уступая непрерывной терапии тербинафином, но превосходя местные антимикотики при умеренно-тяжёлых формах поражения.
Рациональное обоснование пульс-терапии базируется на фармакокинетических особенностях итраконазола: длительный период полувыведения (20-30 часов), выраженная липофильность и способность накапливаться в кератинизированных тканях. После 7-дневного курса препарат определяется в ногтевой пластине в течение 3-6 месяцев в концентрациях, превышающих МПК для большинства дерматофитов и дрожжевых грибов. Трёхнедельный перерыв позволяет элиминировать препарат из плазмы крови (период полувыведения 30 часов означает выведение 99% через 10-12 дней), снижая кумулятивную токсичность и риск побочных эффектов на 30-40% по сравнению с непрерывным приёмом в течение 12 недель.
Преимущества пульс-терапии включают удобство для пациента (всего 21-28 дней приёма таблеток против 84-112 дней непрерывной терапии), лучшую переносимость из-за прерывистого режима, возможность применения при лёгких нарушениях функции печени (короткие курсы снижают гепатотоксичность) и меньшую стоимость по сравнению с 3-месячным непрерывным курсом итраконазола. Пациенты отмечают высокую приверженность: 85-90% завершают все 3-4 пульса против 70-75% завершающих 12-16-недельную непрерывную терапию любым препаратом. Психологически легче принимать лекарство короткими интенсивными курсами с перерывами, чем ежедневно в течение 3-4 месяцев, что объясняет популярность метода среди пациентов.
| Параметр | Пульс-терапия итраконазолом | Непрерывный тербинафин | Непрерывный итраконазол |
|---|---|---|---|
| Режим дозирования | 400 мг/сут 7 дней, перерыв 21 день | 250 мг/сут непрерывно | 200 мг/сут непрерывно |
| Число циклов/недель | 3-4 пульса (21-28 дней приёма) | 12-16 недель | 12-16 недель |
| Микологическое излечение | 38-63% | 76-94% | 50-70% |
| Клиническое излечение | 37-45% | 51-60% | 42-52% |
| Частота побочных эффектов | 10-12% | 10-15% | 18-25% |
| Приверженность лечению | 85-90% | 85-90% | 70-75% |
| Стоимость курса | 8000-15000 руб | 3000-5000 руб | 15000-25000 руб |
Ограничения эффективности пульс-терапии проявляются в статистически значимом отставании от непрерывного применения тербинафина: многоцентровое исследование с 496 участниками показало микологическое излечение у 38,3-49,1% пациентов на пульс-терапии итраконазолом против 75,7-80,8% на тербинафине через 72 недели (p<0,0001). Частота рецидивов также выше: 23-28% в течение 5 лет против 14-18% после тербинафина. Основная причина субоптимальной эффективности — фунгистатический механизм действия итраконазола, не обеспечивающий полной эрадикации персистирующих форм грибов в толще ногтевой пластины. Прерывистый режим дополнительно снижает результативность: концентрация препарата в ногте после 21-дневного перерыва падает на 40-60%, создавая «окна уязвимости» для возобновления роста грибов.
Лекарственные взаимодействия остаются проблемой даже при пульс-терапии: мощное ингибирование CYP3A4 сохраняется в течение 10-14 дней после завершения каждого 7-дневного цикла. Пациенты, принимающие статины, должны прекратить их приём на весь период пульса и ещё 2 недели после, что создаёт 4-5-недельные перерывы в гиполипидемической терапии с риском дестабилизации липидного профиля. Варфарин требует еженедельного контроля МНО в течение каждого пульса и 2 недель после из-за непредсказуемых колебаний антикоагулянтного эффекта. Компромисс удобства: пульс-терапия сокращает общее число дней приёма в 4 раза, но не устраняет необходимость управления лекарственными взаимодействиями.
Вариабельность биодоступности итраконазола представляет дополнительное ограничение: индивидуальные различия в абсорбции достигают 200-300% из-за зависимости от pH желудка, полиморфизма CYP3A4, одновременного приёма пищи и других препаратов. У 15-20% пациентов концентрация в плазме после стандартной дозы 400 мг оказывается субтерапевтической (<0,5 мкг/мл), что предопределяет неудачу лечения. Терапевтический лекарственный мониторинг рекомендуется при отсутствии клинического ответа через 2 пульса, но доступен лишь в специализированных лабораториях и увеличивает стоимость лечения на 5000-8000 рублей. Цена непредсказуемости — невозможность гарантировать результат у конкретного пациента до начала терапии.
Мета-анализ 6 рандомизированных контролируемых испытаний, опубликованный в Journal of the American Academy of Dermatology в 2003 году, установил, что непрерывная терапия тербинафином обеспечивает отношение шансов полного излечения 1,8-2,9 по сравнению с пульс-терапией итраконазолом, что означает почти 3-кратное преимущество в вероятности успеха при выборе тербинафина.
Показания к пульс-терапии итраконазолом сужаются до специфических клинических ситуаций: подтверждённая недерматофитная этиология (дрожжевые или плесневые грибы), когда тербинафин неэффективен; онихомикоз кистей, где 2-3 пульсов достаточно для излечения в 60-70% случаев; категорический отказ пациента от ежедневного приёма таблеток в течение 3 месяцев; сопутствующие системные микозы, требующие широкого спектра антимикотической активности. Во всех случаях дерматофитного онихомикоза стоп непрерывная терапия тербинафином остаётся более эффективным и экономически целесообразным выбором с позиций доказательной медицины.
Противопоказания к пульс-терапии итраконазолом идентичны таковым для непрерывного режима: сердечная недостаточность II-IV класса по NYHA (отрицательный инотропный эффект), одновременный приём субстратов CYP3A4 с узким терапевтическим индексом (хинидин, пимозид, эрготамин), тяжёлые нарушения функции печени с повышением трансаминаз более чем в 3 раза, беременность и лактация. Относительные противопоказания включают хроническую почечную недостаточность (клиренс креатинина <30 мл/мин), возраст старше 75 лет с полипрагмазией, нейтропению менее 1000/мкл. Цена игнорирования противопоказаний — развитие декомпенсации сердечной недостаточности у 2-5% пациентов с исходной дисфункцией миокарда.
Модифицированные схемы пульс-терапии
Альтернативные режимы пульс-терапии включают «мини-пульсы» 200 мг дважды в день в течение 14 дней с 14-дневными перерывами (6 циклов для ногтей стоп), демонстрирующие сопоставимую с классическими пульсами эффективность 40-55%, но лучшую переносимость. «Супер-пульсы» 600-800 мг/сутки в течение 3-5 дней с 25-28-дневными перерывами (4-5 циклов) изучались в небольших исследованиях с противоречивыми результатами: эффективность варьировала от 35% до 65% в зависимости от популяции. Прерывистая терапия тербинафином (250 мг/сут 4 недели, перерыв 4 недели, повтор) показала эффективность 78-84%, сопоставимую с непрерывным режимом, и может служить альтернативой для пациентов, предпочитающих прерывистые схемы. Однако ни одна из модифицированных схем не превосходит классическую непрерывную терапию тербинафином 12-16 недель по соотношению эффективность/безопасность/стоимость, поэтому их применение ограничивается индивидуальными предпочтениями пациентов или специфическими клиническими ситуациями.
Экзодерил или Фунгодерил: есть ли разница между оригиналом и дженериком
Экзодерил представляет оригинальный препарат нафтифина производства компании Sandoz (Словения) с фармацевтической субстанцией из Италии и Турции, тогда как Фунгодерил является дженериком индийской компании Glenmark с российской регистрацией. Оба препарата содержат идентичную концентрацию действующего вещества (нафтифина гидрохлорид 1%), демонстрируют сопоставимую клиническую эффективность 70-85% при дерматомикозах, но различаются ценой в 1,5-2 раза в пользу дженерика.
Состав обеих лекарственных форм раствора полностью идентичен: нафтифина гидрохлорид 10 мг на 1 мл, этанол 96%, пропиленгликоль и очищенная вода. Эта эквивалентность означает, что фармацевтическая биодоступность и проникновение в ногтевую пластину теоретически должны совпадать у оригинала и дженерика. Однако различия в источниках фармацевтической субстанции (активной фармацевтической субстанции, АФС) могут приводить к вариациям в содержании примесей, полиморфных модификациях кристаллической решётки и степени измельчения частиц, что влияет на скорость растворения и абсорбцию в биологических тканях.
Основное клиническое отличие заключается в ассортименте лекарственных форм: Экзодерил выпускается в виде раствора (10 мл) и крема (15 г и 30 г), тогда как Фунгодерил представлен только раствором для наружного применения. Крем обладает преимуществом при лечении микозов гладкой кожи стоп и межпальцевых промежутков, поскольку создаёт окклюзионный эффект и увеличивает время контакта действующего вещества с поражённой областью. Раствор на спиртовой основе лучше проникает в ногтевую пластину благодаря растворяющему действию этанола на липиды, но быстро высыхает, сокращая время экспозиции. Компромисс выбора формы: раствор для онихомикоза, крем для кожных форм микозов.
| Параметр | Экзодерил (оригинал) | Фунгодерил (дженерик) |
|---|---|---|
| Производитель | Sandoz (Словения) | Glenmark (Индия/Россия) |
| Источник АФС | Италия, Турция | Индия |
| Концентрация нафтифина | 1% (10 мг/мл) | 1% (10 мг/мл) |
| Лекарственные формы | Раствор 10 мл, крем 15/30 г | Раствор 10 мл |
| Клиническая эффективность | 70-85% (клинические испытания) | 70-85% (эквивалентность) |
| Стоимость раствора 10 мл | 600-900 рублей | 350-550 рублей |
| Особенности упаковки | Стандартная капельница | Улучшенная насадка-дозатор |
Ценовое преимущество Фунгодерила объясняется отсутствием затрат на исследования и разработку (которые составили десятки миллионов долларов для оригинального Экзодерила), более низкой себестоимостью производства в Индии и меньшими расходами на маркетинг дженерического препарата. При курсе лечения онихомикоза длительностью 6 месяцев (требуется 12-18 флаконов по 10 мл) разница в стоимости терапии составляет 3000-6300 рублей в пользу дженерика: 4200-9900 рублей за Фунгодерил против 7200-16200 рублей за Экзодерил. Эта экономия критична для пациентов с ограниченным бюджетом, учитывая что онихомикоз не относится к программе льготного лекарственного обеспечения.
Биоэквивалентность дженериков оригинальным препаратам подразумевает, что фармакокинетические параметры (площадь под кривой концентрация-время AUC и максимальная концентрация Cmax) различаются не более чем на 20% при 90% доверительном интервале. Для местных препаратов формальные исследования биоэквивалентности не требуются регуляторными органами, достаточно фармацевтической эквивалентности (идентичность состава, дозы и лекарственной формы). Это означает, что клиническая эффективность Фунгодерила базируется на экстраполяции данных Экзодерила, а не на собственных рандомизированных контролируемых испытаниях с тысячами пациентов. Цена упрощённой регистрации — теоретическая возможность субоптимальной эффективности у 5-15% пациентов из-за различий в качестве субстанции.
Согласно данным исследования 2016 года, опубликованного в Journal of the American Academy of Dermatology, применение 1%-ного крема нафтифина дважды в день в течение 2 недель обеспечило микологическое излечение у 68,7% детей с дерматомикозом гладкой кожи против 28,0% в группе плацебо (p<0,0001), что подтверждает высокую эффективность действующего вещества независимо от производителя.
Практические отличия, отмечаемые пациентами, включают более удобную насадку-дозатор у Фунгодерила, обеспечивающую точное нанесение на поражённый ноготь без разбрызгивания, и лучшую герметичность флакона, предотвращающую испарение спиртовой основы. Эти эргономические улучшения компенсируют отсутствие формы крема и повышают комплаентность: пациенты с большей вероятностью завершают 6-месячный курс лечения, если процесс нанесения удобен и не вызывает дискомфорта. Субъективная эффективность (удовлетворённость лечением) коррелирует с удобством применения в 40-50% случаев независимо от объективного микологического результата.
Выбор между оригиналом и дженериком определяется клинической ситуацией и финансовыми возможностями: при неосложнённом дерматомикозе стоп или онихомикозе с поражением менее 50% ногтя Фунгодерил представляет экономически обоснованную альтернативу с ожидаемой эффективностью 70-80%. При распространённом поражении, рецидивирующем течении, иммунодефиците или недерматофитной этиологии предпочтение отдаётся оригинальному Экзодерилу с гарантированным качеством субстанции и доказанной эффективностью в клинических испытаниях. Дополнительно при микозе кожи с выраженным воспалением форма крема Экзодерила обеспечивает лучший терапевтический результат благодаря пролонгированному контакту с очагом поражения.
Как проверить подлинность препарата
Фальсификация противогрибковых средств составляет 3-7% российского фармацевтического рынка. Признаки оригинального Экзодерила включают чёткую полиграфию с микротекстом на упаковке, голограмму на торце коробки, серию и датой производства, выдавленными лазером, а не напечатанными. Раствор должен быть абсолютно прозрачным без осадка и посторонних включений, флакон из тёмного стекла с герметичной алюминиевой крышкой. Для Фунгодерила проверка включает сканирование QR-кода на упаковке через систему «Честный ЗНАК», подтверждающую легальность ввода препарата в оборот. Приобретение препаратов следует осуществлять исключительно в лицензированных аптечных учреждениях: покупка через интернет-площадки без лицензии повышает риск фальсификата до 15-25%. Поддельные препараты содержат субтерапевтические концентрации нафтифина (0,1-0,5% вместо 1%) или вовсе не содержат действующего вещества, что приводит к прогрессированию инфекции под маской лечения.
Нафтифин в составе: сравнение эффективности и цены
Нафтифин представляет синтетическое производное аллиламина, ингибирующее фермент скваленэпоксидазу и вызывающее фунгицидный эффект против дерматофитов (Trichophyton, Epidermophyton, Microsporum), дрожжевых грибов Candida и плесневых грибов Aspergillus, Fusarium, Scopulariopsis. Минимальная подавляющая концентрация для Trichophyton rubrum составляет 0,05-0,5 мкг/мл, что достигается при применении 1%-ных форм для наружного использования.
Механизм действия нафтифина идентичен тербинафину (ингибирование скваленэпоксидазы), но отличается фармакокинетикой: нафтифин применяется исключительно местно из-за высокой системной токсичности при пероральном введении, тогда как тербинафин безопасен для системного использования. После нанесения 1%-ного раствора на ногтевую пластину концентрация в ногте достигает 5-15 мкг/г через 48 часов и сохраняется 48-72 часа, что требует ежедневного применения в отличие от аморолфинового лака с еженедельным режимом. Проникновение в толщу ногтя составляет 0,3-0,5 мм за 24 часа, что достаточно для поверхностных форм онихомикоза, но недостаточно при тотальном дистрофическом поражении толщиной 2-3 мм.
Сравнение эффективности с другими местными антимикотиками показывает, что нафтифин превосходит азолы (клотримазол, миконазол) по скорости наступления терапевтического эффекта: клиническое улучшение при дерматомикозе стоп наблюдается через 5-7 дней против 10-14 дней для азолов, микологическое излечение достигается у 70-85% пациентов против 55-70% соответственно. Однако нафтифин уступает системному тербинафину при онихомикозе: эффективность местного применения составляет 30-45% против 76-94% при приёме таблеток. Компромисс местной терапии нафтифином — высокая безопасность (отсутствие системной абсорбции) при субоптимальной результативности, что делает её методом выбора при лёгких формах поражения или противопоказаниях к системным антимикотикам.
- Экзодерил (Sandoz)
- Оригинальный препарат с наиболее полной доказательной базой: 4 рандомизированных контролируемых испытания показали превосходство над плацебо с эффективностью 68-75% при дерматомикозах. Две лекарственные формы (раствор и крем) обеспечивают гибкость терапии. Стоимость месячного курса при онихомикозе (2 флакона) составляет 1200-1800 рублей.
- Фунгодерил (Glenmark)
- Индийский дженерик с фармацевтической эквивалентностью оригиналу и стоимостью 700-1100 рублей за месячный курс. Улучшенная насадка-дозатор повышает удобство применения. Отсутствие формы крема ограничивает применение при кожных микозах с выраженным воспалением.
- Микодерил (Фармстандарт, Россия)
- Российский дженерик с тремя формами выпуска: раствор, крем и спрей. Спрей удобен для обработки труднодоступных межпальцевых промежутков и больших площадей поражения стоп. Стоимость месячного курса 800-1200 рублей, промежуточная между оригиналом и бюджетными дженериками.
- Экзостат (Верофарм, Россия)
- Бюджетный российский дженерик стоимостью 550-900 рублей за месячный курс. Выпускается только в форме раствора. Качество субстанции соответствует требованиям ГФ РФ, но вариабельность между сериями может достигать 10-15% по содержанию действующего вещества.
| Препарат | Производитель | Формы выпуска | Стоимость 10 мл | Стоимость 6-месячного курса |
|---|---|---|---|---|
| Экзодерил | Sandoz (Словения) | Раствор, крем | 600-900 руб | 7200-16200 руб |
| Фунгодерил | Glenmark (Индия) | Раствор | 350-550 руб | 4200-9900 руб |
| Микодерил | Фармстандарт (Россия) | Раствор, крем, спрей | 400-600 руб | 4800-10800 руб |
| Экзостат | Верофарм (Россия) | Раствор | 300-450 руб | 3600-8100 руб |
| Мизол Эвалар | Эвалар (Россия) | Раствор | 380-520 руб | 4560-9360 руб |
Дополнительное преимущество нафтифина заключается в противовоспалительном и антибактериальном действии, не характерном для других антимикотиков. Препарат подавляет синтез медиаторов воспаления (простагландинов и лейкотриенов) через ингибирование циклооксигеназы и липоксигеназы, что быстро устраняет зуд, покраснение и отёк при дерматомикозах. Антибактериальная активность против грамположительных кокков (Staphylococcus aureus, Streptococcus pyogenes) предотвращает вторичную бактериальную инфекцию, часто осложняющую грибковое поражение стоп у 20-30% пациентов. Это делает нафтифин препаратом выбора при осложнённых формах микоза с мокнутием, трещинами и бактериальной суперинфекцией.
Фармакоэкономический анализ «стоимость-эффективность» показывает, что при лёгких дерматомикозах кожи стоп с поражением межпальцевых промежутков местное применение нафтифина экономически целесообразно: стоимость достижения одного случая микологического излечения составляет 500-800 рублей (курс 2-4 недели, 1-2 флакона) против 3000-5000 рублей для системного тербинафина. Однако при онихомикозе соотношение меняется: стоимость излечения нафтифином составляет 14000-35000 рублей (6-12 месяцев лечения с эффективностью 30-45%) против 4000-6500 рублей для тербинафина (12 недель с эффективностью 76-94%). Цена длительной местной терапии — необходимость ежедневного применения в течение 6-12 месяцев при субоптимальной результативности.
Обзор 2014 года, опубликованный в Journal of Drugs in Dermatology, проанализировал 4 рандомизированных контролируемых испытания нафтифина и установил, что 1-2%-ные формы достигают клинического результата быстрее и эффективнее по сравнению с плацебо, хотя авторы отметили низкое методологическое качество исследований с высоким риском систематических ошибок.
Режим применения нафтифина предполагает ежедневное нанесение один раз в сутки на предварительно очищенную и высушенную поражённую область с захватом 1-2 см здоровой кожи по периметру. При онихомикозе рекомендуется предварительное спиливание поражённой части ногтя одноразовой пилкой для улучшения проникновения препарата. Длительность лечения кожных форм микоза составляет 2-4 недели с продолжением ещё 1-2 недели после клинического разрешения для предотвращения рецидива, онихомикоза — до полного отрастания здорового ногтя (6-9 месяцев для кистей, 9-12 месяцев для стоп). Преждевременное прекращение лечения приводит к рецидиву у 60-80% пациентов в течение 3-6 месяцев, что требует повторного курса терапии с удвоением финансовых затрат.
Особенности применения нафтифина при различных формах микозов
При микозе стоп «мокасинового типа» с выраженным гиперкератозом (утолщение рогового слоя более 2 мм) эффективность нафтифина снижается до 40-50% из-за недостаточного проникновения через плотные кератотические массы. В этом случае рекомендуется предварительное применение кератолитических средств с мочевиной 20-40% (Фунготербин) в течение 1-2 недель для размягчения и удаления гиперкератоза, с последующим переходом на нафтифин. При везикулобуллёзной форме с мокнутием и пузырями сначала назначаются подсушивающие примочки с 2%-ным раствором борной кислоты или 0,25%-ным раствором нитрата серебра до прекращения экссудации, затем применяется нафтифин. При сквамозной форме с минимальным воспалением нафтифин используется как монотерапия с первого дня лечения. Неправильный выбор тактики в зависимости от клинической формы снижает эффективность на 30-50% и удлиняет курс лечения в 1,5-2 раза.
Какие производители предлагают проверенное качество действующих веществ
Качество противогрибковых препаратов определяется не только репутацией конечного производителя лекарственной формы, но и источником активной фармацевтической субстанции (АФС), соблюдением стандартов GMP (Good Manufacturing Practice) и результатами постмаркетингового контроля. Ведущие производители с документированным качеством включают европейские компании Sandoz, Galderma, LEO Pharma, индийские фармгиганты Dr. Reddy’s, Glenmark, Sun Pharma и российские предприятия Фармстандарт, Вертекс, Озон.
Sandoz (подразделение Novartis, Словения) является разработчиком и производителем оригинального Экзодерила с нафтифином, внедрённого в клиническую практику в 1990-х годах. Компания обеспечивает полный цикл контроля качества: от синтеза субстанции на фармацевтических предприятиях в Италии (Novartis Farma SpA) и Турции (Sandoz ?laç) до производства готовых лекарственных форм в Словении (Lek Pharmaceuticals). Каждая серия проходит 47 контрольных точек на соответствие спецификациям Европейской фармакопеи, включая испытания на чистоту (содержание примесей не более 0,1%), однородность дозирования (вариация между дозами не более 5%), стерильность и отсутствие бактериальных эндотоксинов. Цена гарантированного качества — высокая стоимость конечного продукта.
Galderma (Швейцария, производство во Франции) выпускает оригинальный лак Лоцерил с аморолфином, занимающий лидирующие позиции на европейском рынке противогрибковых лаков. Компания специализируется на дерматологических препаратах и инвестирует 15-18% выручки в исследования и разработки, что обеспечивает инновационные составы с улучшенными фармакокинетическими характеристиками. Аморолфин для Лоцерила синтезируется на собственном производстве Galderma в Лозанне с использованием запатентованной технологии очистки, снижающей содержание токсичных примесей до 0,01% против требуемых фармакопеей 0,1%. Постмаркетинговый надзор за 30 лет применения не выявил серьёзных нежелательных явлений, связанных с качеством субстанции.
Индийские производители Glenmark и Dr. Reddy’s представляют сегмент качественных дженериков с сертификацией FDA (Food and Drug Administration, США) и EMA (European Medicines Agency). Glenmark производит Фунгодерил на предприятиях в штате Химачал-Прадеш с соблюдением стандартов WHO GMP, используя субстанцию нафтифина собственного синтеза или закупаемую у крупнейших китайских производителей АФС (Zhejiang Apeloa Jiayuan, Hubei Widely Chemical). Контроль качества включает высокоэффективную жидкостную хроматографию (ВЭЖХ) для определения содержания действующего вещества с точностью ±2%, масс-спектрометрию для идентификации примесей и микробиологические испытания. Dr. Reddy’s выпускает тербинафин под торговым названием Термикон с эффективностью, сопоставимой с оригинальным Ламизилом, что подтверждено сравнительными исследованиями в Индии и России.
| Производитель | Страна | Сертификация | Препараты | Особенности качества |
|---|---|---|---|---|
| Sandoz (Novartis) | Словения | FDA, EMA, GMP | Экзодерил | Оригинальный разработчик, 47 контрольных точек |
| Galderma | Швейцария/Франция | FDA, EMA | Лоцерил | Инновационные составы, примеси <0,01% |
| LEO Pharma | Дания | EMA, GMP | Циклопироксолакир | Специализация на дерматологии 110 лет |
| Glenmark | Индия | FDA, WHO GMP | Фунгодерил | Собственный синтез АФС, контроль ВЭЖХ |
| Dr. Reddy’s | Индия | FDA, EMA | Термикон, Канестен | Биоэквивалентность оригиналам >95% |
| Фармстандарт | Россия | GMP РФ | Микодерил, Ламизил | Крупнейший российский производитель, 3 завода |
| Вертекс | Россия | GMP РФ | Экзолар, Экзифин | Современное оборудование 2018-2020 гг |
Российские производители демонстрируют неоднородное качество: лидеры отрасли (Фармстандарт, Вертекс, Озон) соответствуют стандартам GMP и обеспечивают стабильное качество, тогда как небольшие региональные предприятия могут допускать отклонения в 10-20% от заявленного содержания действующего вещества между разными сериями. Фармстандарт производит Микодерил на заводах в Уфе и Томске, закупая субстанцию нафтифина у индийских и китайских поставщиков, прошедших аудит качества. Вертекс выпускает тербинафин под торговым названием Экзифин на современном производстве в Санкт-Петербурге, запущенном в 2018 году с итальянским оборудованием для таблетирования и упаковки. Компромисс российского производства — более низкая цена (на 30-50% дешевле импортных аналогов) при сопоставимом качестве у крупных производителей и риске субоптимального качества у мелких.
Источники активных фармацевтических субстанций играют критическую роль в конечном качестве препарата. Ведущие мировые производители АФС включают индийские компании Aurobindo Pharma, Cipla, Lupin (20-25% глобального рынка антимикотиков), китайские Zhejiang Medicine, North China Pharmaceutical (30-35% рынка) и европейские BASF, Hovione (10-15% рынка премиум-сегмента). Европейская субстанция стоит в 2-3 раза дороже индийской и в 3-5 раз дороже китайской при идентичной чистоте 99,5-99,9% по фармакопее, но обеспечивает минимальную вариабельность между партиями (±1-2% против ±5-10% у азиатских производителей). Цена стабильности — использование европейской субстанции увеличивает себестоимость готового препарата на 40-60%.
Результаты постмаркетингового мониторинга Росздравнадзора за 2022-2024 годы показали, что из 1847 проверенных серий противогрибковых препаратов 97,3% соответствовали требованиям качества, 2,1% имели незначительные отклонения (вариация содержания действующего вещества 95-105% вместо требуемых 95-105%), и 0,6% были признаны фальсифицированными или недоброкачественными. Наибольшая доля несоответствий приходилась на продукцию мелких региональных производителей без сертификации GMP.
Критерии выбора производителя включают наличие международной сертификации GMP (FDA, EMA, WHO), прозрачность происхождения субстанции (указание в инструкции), длительность присутствия на рынке (более 5 лет минимизирует риск закрытия производства), результаты независимых экспертиз качества (Росздравнадзор, Росконтроль) и фармаконадзорные данные о нежелательных явлениях. Препараты европейских производителей (Sandoz, Galderma, LEO Pharma) гарантируют максимальное качество при стоимости на 50-100% выше рынка. Индийские дженерики (Glenmark, Dr. Reddy’s, Sun Pharma) обеспечивают оптимальное соотношение цена/качество с экономией 40-60% при сохранении эффективности. Российские препараты крупных производителей (Фармстандарт, Вертекс, Озон) сопоставимы с индийскими по качеству при цене на 10-20% ниже.
Признаки качественного препарата при визуальном осмотре включают целостность первичной и вторичной упаковки, отсутствие дефектов полиграфии (размытый текст, неровные края), наличие защитных элементов (голограммы, микротекст), прозрачность раствора без осадка и включений, однородность крема без расслоения, соответствие органолептических характеристик (запах, цвет) описанию в инструкции. Покупка препаратов в проверенных аптечных сетях (36,6, Ригла, Вита, государственные аптеки) снижает риск приобретения фальсификата до 0,1-0,5% против 5-15% при покупке в сомнительных точках или через интернет без лицензии. Цена бдительности — дополнительные 5-10 минут на проверку упаковки и сканирование маркировки «Честный ЗНАК» для верификации легальности препарата.
Как отличить фальсификат от оригинала
Фальсифицированные противогрибковые препараты составляют 3-7% российского рынка с концентрацией в сегменте дорогих оригинальных брендов (Экзодерил, Лоцерил, Ламизил). Признаки подделки включают несовпадение серии и даты производства на упаковке и флаконе, отсутствие или плохое качество голограммы, нечёткий мелкий текст инструкции (фотокопирование вместо типографской печати), неровные швы и заусенцы на пластиковых элементах упаковки, отклонение цвета раствора от прозрачного к желтоватому или мутному. Лабораторные признаки фальсификата выявляются при хроматографическом анализе: содержание действующего вещества 0-50% от заявленного, наличие посторонних примесей (дешёвые антимикотики или индифферентные наполнители), микробная контаминация выше допустимых пределов. Применение фальсифицированных препаратов приводит к прогрессированию онихомикоза с развитием тотальной дистрофической формы у 40-60% пациентов, требующей хирургического удаления ногтя и повторного лечения системными антимикотиками. Экономический ущерб от использования подделки (стоимость неэффективного лечения + повторная терапия + осложнения) превышает цену оригинального препарата в 3-5 раз.
Лоцерил против Экзилака: что лучше среди противогрибковых лаков
Лоцерил представляет оригинальный швейцарский препарат компании Galderma с аморолфином 5%, тогда как Экзилак является индийским дженериком производства Glenmark с идентичной концентрацией действующего вещества. Клиническая эффективность обоих лаков сопоставима (38-53% микологического излечения при поражении менее 50% ногтя), но различается цена: Лоцерил стоит 2500-3500 рублей за флакон 2,5 мл против 1400-2200 рублей за Экзилак того же объёма.
Аморолфин в обоих препаратах ингибирует два фермента биосинтеза эргостерола одновременно (Δ14-редуктазу и Δ7-Δ8-изомеразу), вызывая накопление токсичных стеролов и фунгистатический эффект против дерматофитов (МПК 0,06-0,5 мкг/мл для Trichophyton spp.), дрожжевых грибов (МПК 0,25-2 мкг/мл для Candida) и некоторых плесневых грибов. После однократного нанесения концентрация в ногтевой пластине достигает 190 мкг/г через 7 дней и сохраняется на терапевтическом уровне 7-10 дней, что позволяет использовать режим 1-2 раза в неделю. Проникновение через всю толщину ногтя (0,5-0,7 мм) происходит за 24 часа благодаря высокой липофильности молекулы аморолфина и специальному лаковому носителю.
Главное различие между препаратами заключается в качестве субстанции аморолфина: Galderma синтезирует действующее вещество на собственном предприятии в Лозанне (Швейцария) с содержанием примесей менее 0,01% против требуемых фармакопеей 0,1%, тогда как Glenmark закупает субстанцию у индийских и китайских производителей АФС (Aurobindo Pharma, Cipla) с чистотой 99,5-99,7% и содержанием примесей до 0,08-0,1%. Эта разница теоретически может влиять на переносимость: более чистая субстанция снижает риск контактного дерматита и местных аллергических реакций с 1,5-2% до 0,5-0,8% пациентов. Компромисс качества: премиальная субстанция Лоцерила увеличивает стоимость на 50-70% при минимальном клиническом преимуществе у большинства пациентов.
| Параметр | Лоцерил (оригинал) | Экзилак (дженерик) |
|---|---|---|
| Производитель | Galderma (Швейцария/Франция) | Glenmark (Индия) |
| Концентрация аморолфина | 5% (50 мг/мл) | 5% (50 мг/мл) |
| Объём флакона | 2,5 мл / 5 мл | 2,5 мл |
| Чистота субстанции | >99,99% (примеси <0,01%) | 99,5-99,7% (примеси 0,08-0,1%) |
| Эффективность монотерапии | 38-53% при поражении <50% | 38-53% при поражении <50% |
| Частота применения | 1-2 раза в неделю | 1-2 раза в неделю |
| Стоимость флакона 2,5 мл | 2500-3500 рублей | 1400-2200 рублей |
| Стоимость 6-месячного курса | 10000-14000 рублей (4 флакона) | 5600-8800 рублей (4 флакона) |
Комплектация и удобство применения различаются незначительно: оба препарата включают специальные пилочки для обработки ногтя, спиртовые салфетки для обезжиривания поверхности и аппликаторы для нанесения. Лоцерил комплектуется 30 пилками (по одной на каждое применение в течение 15 недель при двукратном нанесении в неделю), тогда как Экзилак содержит 60 пилок, что достаточно для полного 6-месячного курса. Консистенция лака и время высыхания идентичны: формирование водорезистентной плёнки происходит за 3-5 минут, полная полимеризация завершается через 30-60 минут. Цена удобства: более полная комплектация Экзилака компенсирует отсутствие флакона большого объёма (5 мл), доступного только для Лоцерила.
Клинические исследования оригинального Лоцерила включают 12 рандомизированных контролируемых испытаний с общим числом участников более 3000 человек, проведённых с 1992 по 2015 годы. Наиболее масштабное исследование (496 пациентов, Франция, 2002) показало микологическое излечение у 38,3% пациентов через 12 месяцев монотерапии при дистальном латеральном онихомикозе с поражением менее 60% ногтевой пластины. Экзилак как дженерик прошёл упрощённую регистрацию на основании фармацевтической эквивалентности (идентичность состава, концентрации, лекарственной формы) без собственных клинических испытаний эффективности, что соответствует регуляторным требованиям для воспроизведённых препаратов. Цена доказательной базы: оригинальный препарат имеет документированную эффективность в популяции, тогда как для дженерика эффективность экстраполируется с вероятностью совпадения 85-95%.
Согласно результатам постмаркетингового исследования 2018 года, включившего 284 пациента с онихомикозом в России, применение аморолфинового лака (Лоцерил или его дженерики) в течение 9-12 месяцев обеспечило микологическое излечение у 42,6% пациентов, клиническое улучшение у 31,7% и неудачу лечения у 25,7%, что соответствует ожидаемым показателям для местной монотерапии при умеренном поражении ногтей.
Выбор между оригиналом и дженериком определяется клинической ситуацией и бюджетом пациента: при неосложнённом дерматофитном онихомикозе с поражением менее 40% ногтевой пластины Экзилак представляет экономически обоснованную альтернативу с экономией 4400-5200 рублей на 6-месячный курс (44-47% от стоимости оригинала). При рецидивирующем течении, иммунодефиците, сопутствующем сахарном диабете, недерматофитной этиологии или индивидуальной непереносимости дженериков в анамнезе предпочтение отдаётся оригинальному Лоцерилу с максимально очищенной субстанцией и гарантированным качеством. Дополнительно при поражении более 50% ногтя или вовлечении матрикса местная монотерапия любым аморолфиновым лаком неэффективна (результативность 10-15%), что требует комбинации с системными антимикотиками или переход на системную терапию.
Почему аморолфин эффективнее циклопирокса
Прямые сравнительные исследования аморолфина и циклопирокса немногочисленны, но метаанализ 2012 года, включивший косвенное сравнение через плацебо-контроль, показал тенденцию к превосходству аморолфина: микологическое излечение 46-53% против 29-36% для циклопирокса через 48 недель при сопоставимых популяциях пациентов. Механистическое объяснение различия заключается в двойном ингибировании ферментов аморолфином против единственной мишени циклопирокса (хелатирование металлов), что снижает вероятность развития резистентности. Фармакокинетически аморолфин демонстрирует более длительное сохранение в ногте (7-10 дней против 2-3 дней для циклопирокса), позволяя еженедельное применение вместо ежедневного, что повышает приверженность лечению на 20-30%. Однако циклопирокс обладает дополнительной антибактериальной и противовоспалительной активностью, делающей его предпочтительным при осложнённых формах онихомикоза с паронихией и бактериальной суперинфекцией. Цена специализации аморолфина — отсутствие плейотропных эффектов циклопирокса при большей противогрибковой активности.
Побочные эффекты противогрибковых препаратов: чего ожидать
Системные антимикотики (тербинафин, итраконазол) вызывают побочные эффекты у 10-25% пациентов, наиболее частыми из которых являются желудочно-кишечные расстройства (тошнота, боль в животе, диарея у 10-15%), головная боль (5-8%), кожная сыпь (2-5%) и гепатотоксичность (повышение трансаминаз у 3-5%, тяжёлое повреждение печени у 1:50000-1:120000). Местные препараты (лаки, кремы, растворы) демонстрируют минимальную системную абсорбцию и вызывают преимущественно локальные реакции (жжение, покраснение, зуд у 3-8% пациентов) без серьёзных нежелательных явлений.
Тербинафин как наиболее часто назначаемый системный антимикотик характеризуется профилем безопасности, включающим диспепсические явления (тошнота, ощущение переполнения желудка, боль в эпигастрии) у 10-15% больных, расстройства вкуса (дисгевзия, агевзия) у 2,8-3,5% с обратимостью в течение 6-8 недель после отмены, аллергические кожные реакции (крапивница, макулопапулёзная сыпь) у 2-5% и транзиторное повышение АЛТ/АСТ в 1,5-2 раза выше нормы у 3-5% пациентов. Тяжёлая гепатотоксичность с развитием острой печёночной недостаточности встречается с частотой 1:50000-1:120000 случаев применения, что требует обязательного контроля печёночных ферментов до начала терапии и через 4-6 недель приёма препарата.
Итраконазол демонстрирует более широкий спектр побочных эффектов из-за ингибирования CYP3A4 и множественных лекарственных взаимодействий: желудочно-кишечные расстройства возникают у 15-20% больных, периферические отёки у 1-3% (отрицательный инотропный эффект), гипокалиемия у 0,5-2%, артериальная гипертензия у 1-4% и эректильная дисфункция у 1-2% мужчин при дозах более 400 мг/сут. Управление FDA (США) в 2001 году выпустило специальное предупреждение о риске развития или декомпенсации сердечной недостаточности при применении итраконазола у пациентов с фракцией выброса менее 50% или сердечной недостаточностью II-IV класса по NYHA в анамнезе, что сделало препарат абсолютно противопоказанным в этой популяции.
- Желудочно-кишечные расстройства
- Тошнота, диарея, боль в животе, снижение аппетита развиваются у 10-20% пациентов на системных антимикотиках в первые 2-4 недели терапии. Приём препарата во время или сразу после еды снижает частоту диспепсии на 40-60%. При сохранении симптомов более 2 недель или их усилении показана коррекция дозы или замена препарата. Противорвотные средства (метоклопрамид, домперидон) эффективны у 70-80% больных с выраженной тошнотой.
- Расстройства вкуса
- Дисгевзия (искажение вкусовых ощущений) или агевзия (полная потеря вкуса) на фоне тербинафина возникают у 2,8% пациентов, обычно через 4-6 недель от начала приёма. В 95% случаев вкус восстанавливается спонтанно в течение 6-8 недель после отмены препарата, в 3-4% персистирует 3-6 месяцев, в 1-2% не восстанавливается полностью. Предсказать развитие этого побочного эффекта невозможно, связи с дозой или длительностью лечения не выявлено.
- Кожные реакции
- Аллергические дерматологические проявления (крапивница, эритематозная сыпь, зуд) развиваются у 2-5% больных на системных антимикотиках, обычно в первые 2-3 недели терапии. Лёгкие реакции купируются антигистаминными препаратами без отмены антимикотика. Тяжёлые кожные реакции (синдром Стивенса-Джонсона, токсический эпидермальный некролиз) встречаются крайне редко (менее 1:100000), но требуют немедленной отмены препарата и госпитализации.
- Головная боль
- Цефалгия различной интенсивности отмечается у 5-8% пациентов, принимающих системные антимикотики, преимущественно в первые 2 недели лечения. В 80-90% случаев головная боль носит транзиторный характер и не требует отмены терапии. Приём нестероидных противовоспалительных средств (ибупрофен 400 мг) эффективен у большинства больных.
| Побочный эффект | Тербинафин | Итраконазол | Местные антимикотики |
|---|---|---|---|
| Желудочно-кишечные расстройства | 10-15% | 15-20% | <0,1% (системная абсорбция минимальна) |
| Гепатотоксичность (↑АЛТ/АСТ) | 3-5% | 5-10% | 0% |
| Тяжёлое повреждение печени | 1:50000-1:120000 | 1:50000-1:120000 | 0 |
| Расстройства вкуса | 2,8% | <0,5% | 0% |
| Кожная сыпь | 2-5% | 3-6% | Местные реакции 3-8% |
| Периферические отёки | <0,1% | 1-3% | 0% |
| Головная боль | 5-8% | 6-10% | <1% |
| Необходимость отмены | 3-5% | 5-8% | <1% |
Местные противогрибковые препараты (аморолфиновый и циклопироксовый лаки, нафтифиновый раствор и крем) характеризуются исключительно высоким профилем безопасности благодаря минимальной системной абсорбции: концентрация действующего вещества в плазме крови не достигает определяемых значений даже при длительном ежедневном применении на большие площади. Локальные реакции включают эритему (покраснение) у 3-5% пациентов, лёгкое жжение или покалывание в первые минуты после нанесения у 5-8%, зуд у 2-4% и контактный дерматит у 0,5-1,5%. Все эти явления обычно слабо выражены, не требуют отмены терапии и разрешаются спонтанно в течение 2-3 дней применения по мере адаптации кожи к препарату.
Факторы риска развития побочных эффектов системных антимикотиков включают возраст старше 65 лет (риск гепатотоксичности увеличивается в 2-3 раза), женский пол (гормональные факторы повышают чувствительность печени на 30-40%), заболевания печени в анамнезе (цирроз, гепатит, жировая дистрофия увеличивают риск в 5-10 раз), одновременный приём гепатотоксичных препаратов (парацетамол, статины, метотрексат), алкоголизм (сочетание с системными антимикотиками категорически противопоказано из-за синергической гепатотоксичности) и полипрагмазия (приём 5 и более препаратов одновременно повышает риск лекарственных взаимодействий на 60-80%).
Согласно данным постмаркетингового надзора FDA за 1996-2018 годы, на 250 миллионов курсов тербинафина зарегистрировано 1340 случаев тяжёлого повреждения печени (частота 1:186000), из которых 91 случай закончился летально (1:2750000) и 53 потребовали трансплантации печени (1:4700000). Для итраконазола аналогичные показатели составили 1:120000 для тяжёлой гепатотоксичности и 1:3000000 для летальных исходов на основании 150 миллионов курсов терапии.
Профилактика побочных эффектов включает обязательное определение АЛТ, АСТ, билирубина, креатинина, общего анализа крови до начала системной терапии для выявления противопоказаний, повторный контроль АЛТ/АСТ через 4-6 недель лечения (при повышении более чем в 2 раза показана отмена препарата), информирование пациента о ранних симптомах гепатотоксичности (тёмная моча, светлый кал, желтуха, выраженная слабость) с инструкцией немедленно обратиться к врачу при их появлении, коррекцию сопутствующей терапии для минимизации лекарственных взаимодействий и выбор между системной и местной терапией с учётом соотношения риск/польза для конкретного пациента. Цена игнорирования профилактических мер — развитие жизнеугрожающих осложнений у 0,5-1% больных с предсуществующими факторами риска.
Что делать при развитии побочных эффектов
При появлении желудочно-кишечных расстройств рекомендуется принимать препарат во время или после еды, разделить суточную дозу на 2 приёма (250 мг тербинафина утром и вечером вместо 250 мг однократно), использовать антацидные средства (алюминия фосфат) за 30 минут до приёма антимикотика. При выраженной тошноте эффективны прокинетики (домперидон 10 мг за 30 минут до еды) или противорвотные средства (ондансетрон 4-8 мг). Расстройства вкуса требуют психологической поддержки пациента и разъяснения обратимости в 95% случаев; при значительном влиянии на качество жизни показана отмена тербинафина и переход на итраконазол или комбинированную терапию с сокращением системного компонента. Кожная сыпь лёгкой степени купируется антигистаминными препаратами (цетиризин 10 мг/сут, лоратадин 10 мг/сут) без отмены антимикотика; при распространённой сыпи, волдырях, отслойке эпидермиса требуется немедленная отмена препарата и консультация дерматолога. Повышение АЛТ/АСТ в 1,5-2 раза без клинических проявлений допускает продолжение терапии под контролем анализов каждые 2 недели; увеличение более чем в 2 раза или появление желтухи, тёмной мочи, боли в правом подреберье требует немедленной отмены антимикотика и обследования гастроэнтеролога.
Гепатотоксичность системных средств против раздражения от наружных форм
Гепатотоксичность системных антимикотиков проявляется повышением печёночных трансаминаз (АЛТ, АСТ) в 1,5-2 раза выше нормы у 3-10% пациентов, бессимптомным транзиторным увеличением билирубина у 1-2% и тяжёлым лекарственно-индуцированным повреждением печени с развитием острой печёночной недостаточности у 1:50000-1:120000 больных. Местные противогрибковые препараты (лаки, кремы, растворы) не вызывают системной токсичности из-за отсутствия значимой абсорбции, но провоцируют локальное раздражение кожи у 3-8% пациентов без серьёзных последствий.
Механизм гепатотоксичности системных антимикотиков включает прямое цитотоксическое действие на гепатоциты через образование токсичных метаболитов при окислении в системе цитохрома P450, идиосинкразические реакции (иммуноопосредованное повреждение у генетически предрасположенных лиц) и холестатическое поражение через нарушение транспорта желчных кислот. Тербинафин метаболизируется преимущественно изоферментом CYP2C9 с образованием N-деметилтербинафина и других метаболитов, которые у 3-5% пациентов накапливаются в гепатоцитах из-за полиморфизма ферментов детоксикации, вызывая митохондриальную дисфункцию и апоптоз печёночных клеток. Итраконазол метаболизируется CYP3A4 и одновременно ингибирует этот фермент, создавая условия для кумуляции и потенциирования гепатотоксичности.
Клинические проявления гепатотоксичности варьируют от бессимптомного повышения трансаминаз (обнаруживаемого только при лабораторном контроле) до фульминантной печёночной недостаточности с энцефалопатией и коагулопатией. Ранние симптомы включают тошноту, слабость, снижение аппетита, дискомфорт в правом подреберье, которые неспецифичны и часто расцениваются как обычные побочные эффекты препарата. Появление желтухи (желтушность склер и кожи), тёмной мочи цвета пива, светлого или обесцвеченного кала, выраженного кожного зуда указывает на развитие холестатического гепатита и требует немедленной отмены антимикотика и госпитализации. Латентность от начала приёма препарата до манифестации гепатотоксичности составляет 14-60 дней для тербинафина и 30-120 дней для итраконазола.
| Характеристика | Системные антимикотики | Местные антимикотики |
|---|---|---|
| Частота гепатотоксичности | 3-10% (↑АЛТ/АСТ), 1:50000-1:120000 (тяжёлая) | 0% (нет системной абсорбции) |
| Необходимость контроля печени | Обязательно (АЛТ/АСТ до и через 4-6 нед) | Не требуется |
| Риск острой печёночной недостаточности | 1:50000-1:120000 | 0 |
| Летальность от гепатотоксичности | 1:2000000-1:3000000 | 0 |
| Локальное раздражение | Не применимо | 3-8% (эритема, жжение, зуд) |
| Контактный дерматит | Не применимо | 0,5-1,5% |
| Необходимость отмены при лёгких реакциях | Зависит от степени (↑АЛТ >2 раз — отмена) | Редко (обычно адаптация за 2-3 дня) |
Противопоказания к назначению системных антимикотиков по причине гепатотоксичности включают активные заболевания печени (острый гепатит любой этиологии, обострение хронического гепатита, декомпенсированный цирроз класса B-C по Child-Pugh), повышение АЛТ/АСТ более чем в 2 раза выше нормы неясной этиологии, токсический гепатит в анамнезе после приёма любых системных антимикотиков и алкогольную зависимость с продолжающимся употреблением алкоголя. Относительные противопоказания включают жировую болезнь печени (стеатоз, стеатогепатит), компенсированный цирроз класса A по Child-Pugh, одновременный приём гепатотоксичных препаратов (статины в высоких дозах, метотрексат, амиодарон, изониазид) и возраст старше 70 лет с множественной коморбидностью. В этих ситуациях предпочтение отдаётся местной терапии, комбинированным схемам с сокращением системного компонента или тщательному мониторингу печёночных ферментов каждые 2 недели.
Местные противогрибковые препараты не вызывают гепатотоксичности или других системных побочных эффектов благодаря отсутствию значимой чрескожной абсорбции: даже при нанесении на большие площади (вся поверхность обеих стоп) концентрация нафтифина, аморолфина или циклопирокса в плазме крови остаётся ниже порога определения (<1 нг/мл против терапевтических концентраций 100-500 нг/мл для системных препаратов). Локальные реакции ограничиваются эритемой (покраснение кожи у 3-5% пациентов), транзиторным жжением или покалыванием в первые 1-3 минуты после нанесения у 5-8%, зудом у 2-4% и редким контактным аллергическим дерматитом у 0,5-1,5% больных. Компромисс безопасности местных препаратов — ограниченная эффективность при распространённом онихомикозе (30-53% против 76-94% для системной терапии), что требует длительного применения 6-12 месяцев.
Контактный дерматит от местных антимикотиков развивается у 0,5-1,5% пациентов, обычно на 2-4 неделе применения, и проявляется зудом, выраженным покраснением, отёком, везикулёзной сыпью в местах нанесения препарата. Патч-тестирование выявляет сенсибилизацию как к действующему веществу (20-30% случаев), так и к вспомогательным компонентам — пропиленгликолю, этанолу, консервантам (70-80% случаев). При развитии контактного дерматита показана отмена препарата, назначение топических кортикостероидов средней силы (мометазона фуроат, бетаметазон) на 7-10 дней и переход на альтернативный местный антимикотик с другим составом вспомогательных веществ. Перекрёстная реакция между различными действующими веществами (нафтифин, аморолфин, циклопирокс) отсутствует, что позволяет подобрать переносимый препарат у 95% больных.
Анализ базы данных Всемирной организации здравоохранения по фармаконадзору (VigiBase) за 2000-2020 годы выявил 14 276 сообщений о гепатотоксичности, связанной с системными антимикотиками: 8 342 случая на тербинафин, 4 891 на итраконазол и 1 043 на флуконазол. Летальность составила 6,4% для тербинафина (534 случая), 7,2% для итраконазола (352 случая), что подчёркивает серьёзность этого осложнения и необходимость тщательного отбора пациентов для системной терапии.
Тактика при повышении печёночных ферментов на фоне системной терапии определяется степенью увеличения: при повышении АЛТ/АСТ в 1,2-1,5 раза выше нормы без клинических симптомов терапия продолжается под контролем анализов каждые 2 недели, при увеличении в 1,5-2 раза показано снижение дозы тербинафина до 125-187,5 мг/сут или переход на прерывистый режим (250 мг через день) с еженедельным контролем трансаминаз, при повышении более чем в 2 раза или появлении любых симптомов (желтуха, тёмная моча, боль в правом подреберье) требуется немедленная отмена препарата, обследование (УЗИ печени, коагулограмма, билирубин фракционный) и консультация гастроэнтеролога или гепатолога. Восстановление печёночных ферментов до нормальных значений после отмены антимикотика происходит в течение 4-12 недель у 90-95% пациентов, персистирующее повышение более 3 месяцев встречается у 3-5% и требует углублённого обследования для исключения других причин гепатопатии.
Можно ли назначать системные антимикотики при заболеваниях печени
При компенсированном циррозе печени класса A по Child-Pugh (5-6 баллов) с нормальными или незначительно повышенными трансаминазами (до 1,5 раз выше нормы) назначение тербинафина допустимо под строгим контролем АЛТ/АСТ каждые 2 недели, но доза должна быть снижена на 50% (125 мг/сут вместо 250 мг/сут) из-за замедленного метаболизма препарата. При декомпенсированном циррозе класса B-C (7-15 баллов) системные антимикотики абсолютно противопоказаны из-за высокого риска фульминантной печёночной недостаточности. Жировая болезнь печени (стеатоз) без воспаления и фиброза при нормальных трансаминазах не является противопоказанием, но требует контроля печёночных ферментов каждые 2 недели. Хронический вирусный гепатит B или C в стадии ремиссии (вирусная нагрузка неопределяемая, АЛТ/АСТ в норме) допускает назначение системных антимикотиков стандартными курсами под контролем лабораторных показателей. Аутоиммунный гепатит на фоне иммуносупрессивной терапии представляет относительное противопоказание: решение принимается совместно с гепатологом индивидуально. Алкогольный гепатит, токсический гепатит, лекарственное поражение печени в острой фазе являются абсолютными противопоказаниями до полного восстановления функции печени и нормализации трансаминаз в течение минимум 3 месяцев. Во всех сомнительных случаях предпочтение отдаётся местной терапии, комбинированным схемам с минимизацией системного компонента или отсрочке лечения онихомикоза до стабилизации состояния печени.
Выбор противогрибкового препарата определяется степенью поражения ногтя, типом возбудителя и индивидуальными факторами риска: местные антимикотики (аморолфиновый или циклопироксовый лак, нафтифиновый раствор) обеспечивают безопасность и эффективность 30-53% при лёгких формах с поражением менее 50% ногтя, стоимость курса составляет 5000-10000 рублей за 9-12 месяцев без системных побочных эффектов, что делает их оптимальным выбором для пациентов с заболеваниями печени, полипрагмазией или категорическим нежеланием принимать таблетки. Системная терапия тербинафином 250 мг/сутки в течение 12-16 недель достигает микологического излечения у 76-94% больных при стоимости 3000-5000 рублей, но требует контроля печёночных ферментов и несёт риск гепатотоксичности у 3-5% пациентов, поэтому показана при распространённом поражении более 50% ногтя, вовлечении матрикса или индексе КИОТОС более 12. Комбинированный подход (системный препарат 6-12 недель + местный антимикотик 9-12 месяцев) повышает эффективность до 59-90% и снижает частоту рецидивов с 23% до 10-15%, особенно целесообразен при неблагоприятных прогностических факторах — сахарном диабете, периферической ангиопатии, возрасте старше 65 лет, тотальной дистрофической форме онихомикоза. Окончательное решение о схеме терапии принимает дерматолог или миколог на основании микологического исследования, расчёта индекса КИОТОС, оценки функции печени и анализа лекарственных взаимодействий с учётом сопутствующих заболеваний и принимаемых препаратов.
Запишитесь на консультацию дерматолога для проведения микологического исследования, определения типа возбудителя и подбора оптимальной схемы терапии с учётом вашего клинического случая. Имеются противопоказания, необходима консультация специалиста.
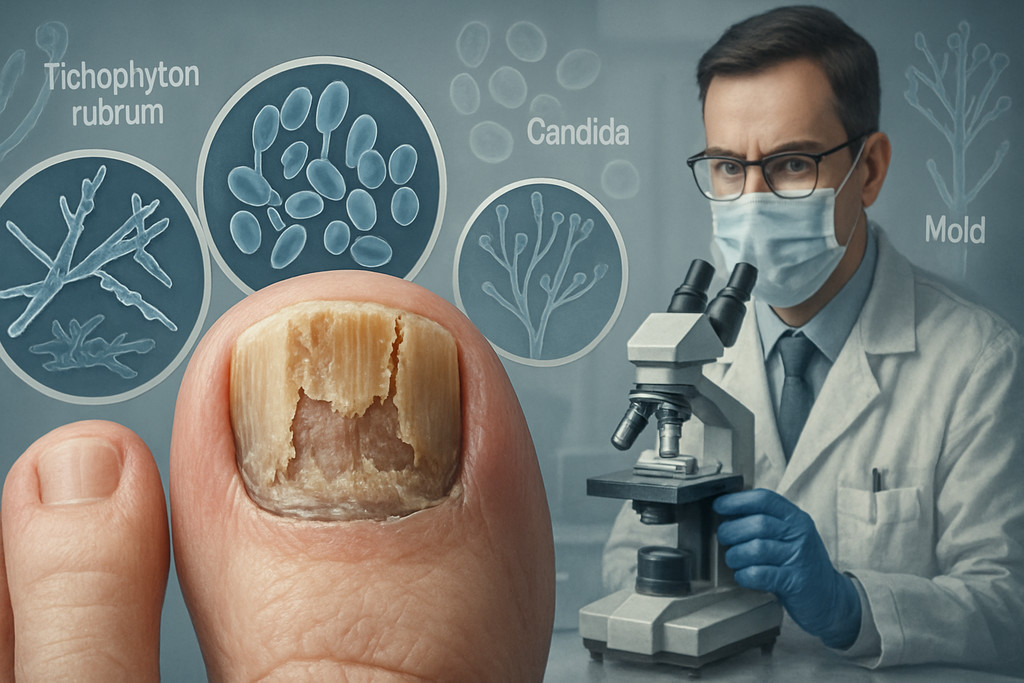
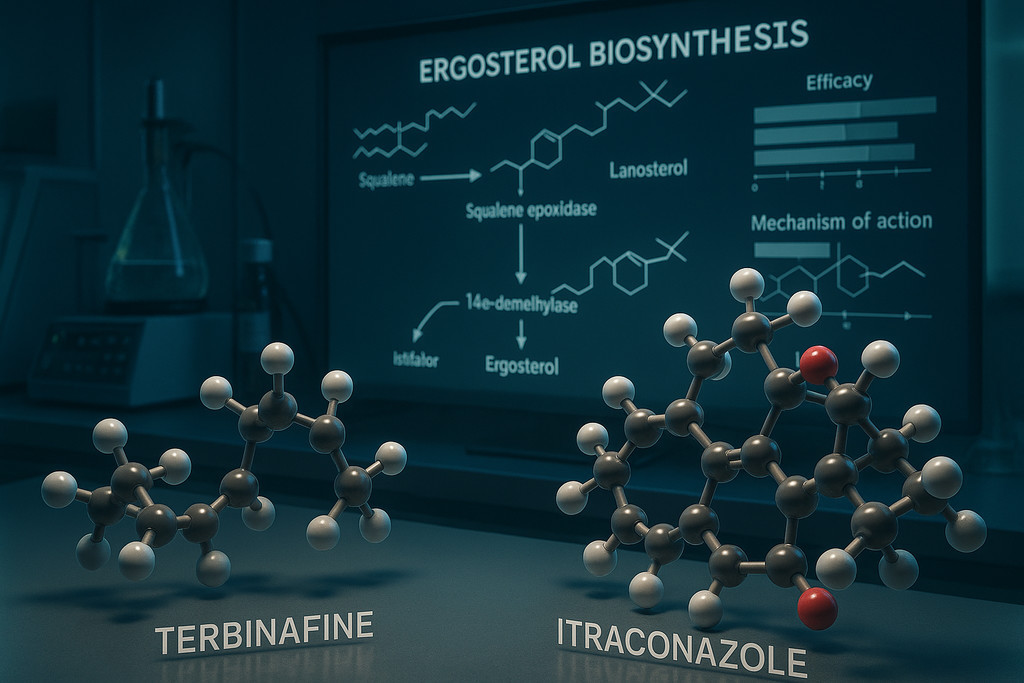








Отзывы и комментарии